1、免疫检测的基础知识
ELISA是一种免疫测定。免疫测定(immunoassay,IA)是应用免疫学技术测定标本的方法。在临床检验中主要通过抗原抗体反应检测体液中的抗体或抗原性物质。
1.1 抗原
抗原是能在机体中引起特异性免疫应答的物质。抗原进入机体后,可刺激机体产生抗体和引起细胞免疫。在免疫测定中,抗原是指能与抗体结合的物质。能在机体中引起抗体产生的抗原多为分子量大于5000的蛋白质。小分子化合物在与大分子蛋白质结合后能引起机体产生特异性抗体的,称为半抗原(hapten)。例如某些激素、药物等。抗原的反应性取决于抗原决定簇(antigenic determinant),或称为表位(epitope)。一个抗原分子可带有不同的决定簇。
1.2 抗体
1.2.1 抗体的结构
抗体是能与抗原特异性结合的免疫球蛋白(immunoglobulin,Ig)。Ig分五类,即IgG、IgA、IgM、IgD和IgE。与免疫测定有关的Ig主要为IgG和IgM。Ig由两个轻链(L)和两个重链(H)的单体组成。Ig的轻链是相同的,有κ(kappa)和λ(Lambda)两种型别。五类Ig的重链结构不同,这决定了它们的抗原性也不同。IgG和IgM的重链分别称为γ(gamma)链和μ(mu)链。IgG的结构见图。
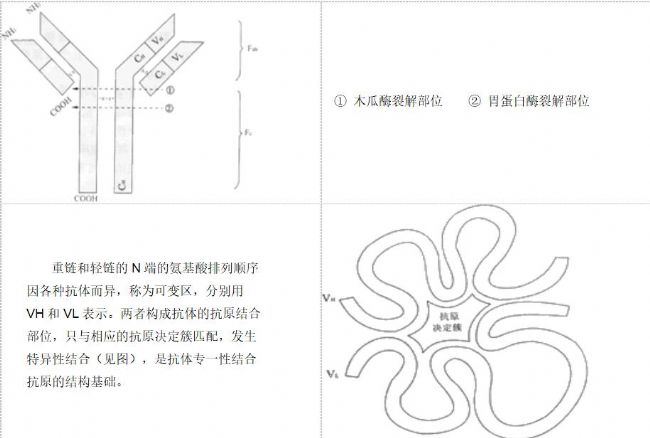
IgG可被木瓜蛋白酶分解为三个区段,其中两个相同的区段称抗原结合片段(Fab)。每个Fab都保存结合抗原的能力,但只有一个抗原结合位点,是单价的,与抗原结合后不出现凝集或沉淀。另一区段称Fc段,无抗体活性,但具有IgG特有
的抗原性。
IgG可被胃蛋白酶分解为两个片段,一个Fab双体,称F(ab')2,能和两个相同的抗原结合;另一片段类似Fc,随后被分解成小分子多肽,无生物活性。
IgM是由五个单体组成的五聚体,含10个重链和10个轻链,具有10个抗原结合价,由于空间位置的影响,只表现为五个抗原结合价。IgM分子量约为900000,IgG分子量约为150000。
机体被微生物感染后,先产生IgM抗体,然后产生IgG抗体。经过一段时间,IgM抗体量逐渐减少而消失,而IgG抗体可长期存在,在疾病痊愈后可持续数年之久。
IgM抗体一般为保护性抗体,具有免疫性。因此IgM抗体的测定,对某些传染病如甲型肝炎有较高的临床诊断价值。
1.2.2 抗体的产生
机体受抗原刺激后,B淋巴细胞产生相应的抗体。含有抗体的血清称为抗血清(antiserum)。每一系B细胞只产生针对某一抗原决定簇的抗体。如将多种抗原或含有多个抗原决定簇的抗原注入机体,则将由多系的B细胞产生相应的多种抗体,这些抗体均存在于免疫血清中。免疫测定中所用的抗血清一般用抗原免疫兔、羊或马制得。产生抗体的B细胞可在体外与繁殖力强的肿瘤细胞融合成杂交瘤细胞。将单个杂交瘤细胞分离,在体内或体外培养而分泌的抗体单克隆抗体(monoclonal antibody,McAb或Mab)。单克隆抗体仅针对一种抗原决定簇,具有很高的特异性。单克隆抗体通常用抗原免疫小鼠制备。将免疫的脾细胞(含产生抗体的B细胞)与小鼠肿瘤细胞融合,分离杂交瘤细胞,接种于小鼠腹腔,产生的腹水中含有浓度很高的单克隆抗体。
1.3 抗原抗体反应
1.3.1 可逆性 抗原与抗体结合形成抗原抗体复合物的过程是一种动态平衡,其反应式为:Ag+Ab→Ag·Ab。.抗体的亲和力(affinity)是抗原抗体间的固有结合力,可以平衡常数K表示:K=[Ag·Ab]/[Ag][Ab]。Ag·Ab的解离程度与K值有关。高亲和力抗体的抗原结合点与抗原的决定簇在空间构型上非常适合,两者结合牢固,不易解离。解离后的抗原或抗体均能保持原有的结构和活性,因此可用亲和层析法来提纯抗原或抗体。在抗血清中,特异性的IgG抗体仅占总IgG中的极小部分。用亲和层析法提取的特异性抗体,称为亲和层析纯抗体,应用于免疫测定中可得到更好的效果。
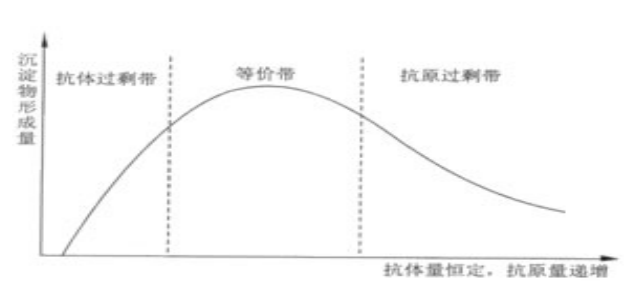
1.3.2 最适比例 在恒定量的抗体中加入递增量的抗原形成抗体复合物(沉淀)的量见图1-4。曲线的高峰部分是抗原抗体比例最合适的范围,称为等价带(zone of equivalence)。在等价带前后分别为抗体过剩带和抗原过剩带。如果抗原或抗体极度过剩,则无沉淀物形成,在免疫测定中称为带现象(zone phenomenon)。抗体过量称为前带(prezone),抗原地过量称为后带(postzone)。在用免疫学方法测定抗原时,应使反应系统中有足够的抗体量,否则测得的量会小于实际含量,甚至出现假阴性。
1.3.3 特异性 抗原抗体的结合实质上只发生在抗原的抗原决定簇与抗体的抗原结合位点之间。由于两者在化学结构和空间构型上呈互补关系,所以抗原抗体反应具有高度的特异性。例如乙肝病毒中的表面抗原(HBsAg)、e抗原(HBeAg)和核心抗体(HBcAg),虽来源于同一病毒,但仅与其相应的抗体结合,而不与另外两种抗体反应。抗原抗体反应的这种特异性使免疫测定能在一非常复杂的蛋白质化合物(例如血清)中测定某一特定的物质,而不需先分离待检物。
但是这种特异性也不是绝对的。假使两种化合物有着部分相同的结构,在抗原抗体反应中可出现交叉反应。例如:绒毛膜促性腺激素(hCG)和黄体生成激素(LH)均由α和β两个亚单位组成,其结构的不同处在β亚单位,而两者的α亚单位是同类的。用hCG免疫动物所得的抗血清中含有抗α-hCG和抗β-hCG两种抗体,抗α-hCG抗体将与LH发生交叉反应。在临床检验中,如用抗hCG抗血清作为妊娠诊断试剂检定尿液中hCG,只能用于hCG浓度较高的试验,否则妇女生理性排泄入尿液中的微量LH将与之发生交叉反应。因此在作为早孕诊断(敏感度应达到50mIu/mlhCG)的实际中必须应用只对hCG特异的抗β-hCG,以避免与其它激素的交叉反应的发生。
1.3.4 敏感性 在测定血清中某一物质的含量时,化学比色法的敏感度为mg/ml水平,酶反应测定法的敏感度约为5~10μg/ml,免疫测定中凝胶扩散法和浊度法的敏感度与酶反应法相仿。标记的免疫测定的敏感度可提高数千倍,达ng/ml水平。例如,用放射免疫测定法或酶免疫测定法测定HBsAg,其敏感度可达0.1ng/ml。
1.4 免疫测定在临床检验中的应用
由于各种抗原成份,包括小分子的半抗原,均可用以制备特异性的抗血清或单克隆抗体,利用此抗体作为试剂就可检测标本中相应的抗原,因此免疫测定的应用范围极广,在临床检验中可用于测定:
1) 体液中的各种蛋白质,包括含量极少的蛋白质如甲胎蛋白等。
2) 激素,包括小分子量的甾体激素等。
3) 抗生素和药物。
4) 病原体抗原,HBsAg、HBeAg等。
5) 另外,也可利用纯化的抗原检测标本中的抗体,例如抗-HBs等。
1.5. 标记的免疫测定
如上所述,免疫测定是一种很敏感的测定方法,抗原抗体反应后直接测定形成的沉淀或浊度,敏感度可达5~10μg/ml,但在临床检验中,某些待测物在标本中的含量远低于这一水平,因此要寻找增加敏感度的方法。标记的免疫测定是将检测试剂中的抗原或抗体用可微量测定的物质加以标记,通过测定标记物来提高敏感度。在放射免疫测定和酶免疫测定中,标记物分别为放射性核素和酶,最后用测定放射性和酶活力来计算待检物的量,敏感度可比直接测定沉淀物提高数百至数千倍。在标记免疫测定中,一般加入过量的标记试剂以保证与待测物彻底反应。以标记抗体(Ab※)检测抗原(Ag)为例,反应式如下:Ag+ Ab※ → AgAb※+ Ab※。在反应产物中有与Ag结合的Ab※和游离和Ab※,如不将两者分离而测定标记物,测得的结果将为两者之和。因此,游离标记物与结合标记物的分离是标记免疫测定中的重要步骤。可采用多种手段,固相载体是其中之一。如将抗原或抗体包被在固相载体上,然后再与标记的抗原或抗体直接反应,结合的标记物被固定在载体上,而游离的标记物留于溶液中。这样可以通过洗涤将游离的Ab※除去,结合标记物的测定可在固相上进行。
1.6. 酶免疫测定
酶免疫测定(enzyme immunoassay)可分为均相(homogenous)和非均相(heterogenous)两种类型。在均相EIA中可不需进行游离的和结合的标记物的分离而直接测定标记物。例如在某种条件下,抗原抗体反应后形成的酶标记抗原抗体复合物中的酶失去其对底物作用的活力,因而测出的酶活力直接反映游离的酶标记物。均相EIA在临床检验中较少应用。非均相EIA需先进行游离的和结合的标记物的分离。如前所述,固相载体可用作一种分离手段。这种固相酶免疫测定方法在1971年最初建立时称为酶联免疫吸附剂测定(enzyme linked immunosorbent assay),简称ELISA,在国内有译作酶联免疫吸附试验或酶标,已习用。
2、ELISA的原理和类型
2.1. ELISA的原理
ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。在测定时,受检标本(测定其中的抗体或抗原)与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与液体中的其他物质分开。再加入酶标记的抗原或抗体,也通过反应而结合在固相载体上。此时固相上的酶量与标本中受检物质的量呈一定的比例。加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,故可根据呈色的深浅进行定性或定量分析。由于酶的催化效率很高,间接地放大了免疫反应的结果,使测定方法达到很高的敏感度。
2.2. ELISA的类型
ELISA可用于测定抗原,也可用于测定抗体。在这种测定方法中有三个必要的试剂:(1)固相的抗原或抗体,即"免疫吸附剂"(immunosorbent);(2)酶标记的抗原或抗体,称为“酶联物”、“结合物”(conjugate);(3)酶反应的底物。根据试剂的来源和标本的情况以及检测的具体条件,可设计出各种不同类型的检测方法。用于临床检验的ELISA主要有以下几种类型:
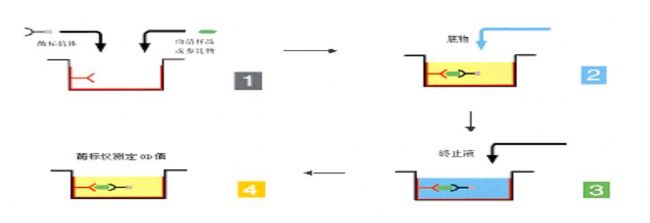
2.2.1 双抗体夹心法测抗原
双抗体夹心法是检测抗原最常用的方法,操作步骤如下:
1) 将特异性抗体与固相载体联结,形成固相抗体。洗涤除去未结合的抗体及杂质。
2) 加受检标本,保温反应。标本中的抗原与固相抗体结合,形成固相抗原抗体复合物。洗涤除去其他未结合物质。
3) 加酶标抗体,保温反应。固相免疫复合物上的抗原与酶标抗体结合。彻底洗涤未结合的酶标抗体。此时固相载体上带有的酶量与标本中受检抗原的量相关。
4) 加底物显色。固相上的酶催化底物成为有色产物。通过比色,测知标本中抗原的量。
在临床检验中,此法适用于检验各种蛋白质等大分子抗原,例如HBsAg、HBeAg、AFP、hCG等。只要获得针对受检抗原的异性抗体,就可用于包被固相载体和制备酶结合物而建立此法。如抗体的来源为抗血清,包被和酶标用的抗体最好分别取自不同种属的动物。如应用单克隆抗体,一般选择两个针对抗原上不同决定簇的单抗,分别用于包被固相载体和制备酶结合物。这种双位点夹心法具有很高的特异性,而且可以将受检标本和酶标抗体一起保温反应,作一步法检测。
在一步法测定中,当标本中受检抗原的含量很高时,过量抗原分别和固相抗体及酶标抗体结合,而不再形成"夹心复合物"。类同于沉淀反应中抗原过剩的后带现象,此时反应后显色的吸光值(位于抗原过剩带上)与标准曲线(位于抗体过剩带上)某一抗原浓度的吸光值相同,如按常法测读,所得结果将低于实际的含量,这种现象被称为钩状效应(hook effect),因为标准曲线到达高峰后呈钩状弯落。钩状效应严重时,反应甚至可不显色而出现假阴性结果。因此在使用一步法试剂测定标本中含量可异常增高的物质(例如血清中HBsAg、AFP和尿液hCG等)时,应注意可测范围的最高值。用高亲和力的单克隆抗体制备此类试剂可削弱钩状效应。
假使在被测分子的不同位点上含有多个相同的决定簇,例如HBsAg的a决定簇,也可用针对此决定的同一单抗分别包被固相和制备酶结合物。但在HBsAg的检测中应注意亚型问题,HBsAg有adr、adw、ayr、ayw4个亚型,显然每种亚型均有相同的a决定簇的反应性,这也是用单抗作夹心法应注意的问题。
双抗体夹心法测抗原的另一注意点是类风湿因子(RF)的干扰。RF是一种自身抗体,多为IgM型,能和多种动物IgG的Fc段结合。用作双抗体夹心法检测的血清标本中如含有RF,它可充当抗原成份,同时与固相抗体和酶标抗体结合,表现出假阳性反应。采用F(ab')或Fab片段作酶结合物的试剂,由于去除了Fc段,从而可消除RF的干扰。双抗体夹心法ELISA试剂是否受RF的影响,已被列为这类试剂的一项考核指标(参见6.2)。
双抗体夹心法适用于测定二价或二价以上的大分子抗原,但不适用于测定半抗原及小分子单价抗原,因其不能形成两位点夹心。
2.2.2 双抗原夹心法测抗体
反应模式与双抗体夹心法类似。用特异性抗原进行包被和制备酶结合物,以检测相应的抗体。与间接法测抗体的不同之处为以酶标抗原代替酶标抗抗体。此法中受检标本不需稀释,可直接用于测定,因此其敏感度相对高于间接法。乙肝标志物中抗HBs的检测常采用本法。本法关键在于酶标抗原的制备,应根据抗原结构的不同,寻找合适的标记方法。
2.2.3 间接法测抗体(我公司分装TORCH及传染病试剂盒大多采用本法)
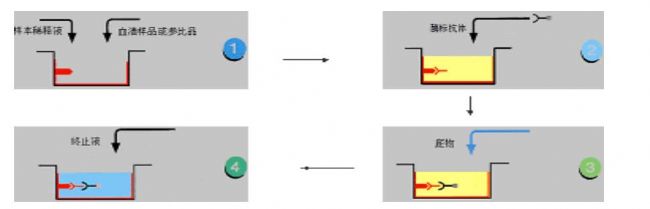
间接法是检测抗体常用的方法。其原理为利用酶标记的抗抗体(抗人免疫球蛋白抗体)以检测与固相抗原结合的受检抗体,故称为间接法(见图2-3)。操作步骤如下:
1)将特异性抗原与固相载体联结,形成固相抗原。洗涤除去未结合的抗原及杂质。
2)加稀释的受检血清,保温反应。血清中的特异抗体与固相抗原结合,形成固相抗原抗体复合物。经洗涤后,固相载体上只留下特异性抗体,血清中的其他成份在洗涤过程中被洗去。
3)加酶标抗抗体。可用酶标抗人Ig以检测总抗体,但一般多用酶标抗人IgG检测IgG抗体。固相免疫复合物中的抗体与酶标抗体抗体结合,从而间接地标记上酶。洗涤后,固相载体上的酶量与标本中受检抗体的量正相关。
4)加底物显色
本法主要用于对病原体抗体的检测而进行传染病的诊断。间接法的优点是只要变换包被抗原就可利用同一酶标抗抗体建立检测相应抗体的方法。
间接法成功的关键在于抗原的纯度。虽然有时用粗提抗原包被也能取得实际有效的结果,但应尽可能予以纯化,以提高试验的特异性。特别应注意除去能与一般健康人血清发生反应的杂质,例如以E.Coli为工程酶的重组抗原,如其中含有E.Coli成份,很可能与受过E.Coli感染者血清中的抗E.Coli抗体发生反应。抗原中也不能含有与酶标抗人Ig反应的物质,例如来自人血浆或人体组织的抗原,如不将其中的Ig去除,试验中也发生假阳性反应。另外如抗原中含有无关蛋白,也会因竟争吸附而影响包被效果。
间接法中另一种干扰因素为正常血清中所含的高浓度的非特异性抗体。病人血清中受检的特异性IgG只占总IgG中的一小部分。IgG的吸附性很强,非特异IgG可直接吸附到固相载体上,有时也可吸附到包被抗原的表面。因此在间接法中,抗原包被后一般用无关蛋白质(例如牛血清蛋白)再包被一次,以封闭(blocking)固相上的空余间隙。另外,在检测过程中标本须先行稀释(1:40~1:200),以避免过高的阴性本底影响结果的判断。
2.2.4 竞争法测抗体
当抗原材料中的干扰物质不易除去,或不易得到足够的纯化抗原时,可用此法检测特异性抗体。其原理为标本中的抗体和一定量的酶标抗体竞争与固相抗原结合。标本中抗体量越多,结合在固相上的酶标抗体愈少,因此阳性反应呈色浅于阴性反应。如抗原为高纯度的,可直接包被固相。如抗原中会有干扰物质,直接包被不易成功,可采用捕获包被法,即先包被与固相抗原相应的抗体,然后加入抗原,形成固相抗原。洗涤除去抗原中的杂质,然后再加标本和酶标抗体进行竞争结合反应。竞争法测抗体有多种模式,可将标本和酶标抗体与固相抗原竞争结合,抗HBc ELISA一般采用此法。另一种模式为将标本与抗原一起加入到固相抗体中进行竞争结合,洗涤后再加入酶标抗体,与结合在固相上的抗原反应。抗HBe的检测一般采用此法。
2.2.5 竞争法测抗原
小分子抗原或半抗原因缺乏可作夹心法的两个以上的位点,因此不能用双抗体夹心法进行测定,可以采用竞争法模式。其原理是标本中的抗原和一定量的酶标抗原竞争与固相抗体结合。标本中抗原量含量愈多,结合在固相上的酶标抗原愈少,最后的显色也愈浅。小分子激素、药物等ELISA测定多用此法。
2.2.6 捕获包被法测抗体(经典方法)
IgM抗体的检测用于传染病的早期诊断中。间接法ELISA一般仅适用于检测总抗体或IgG抗体。如用抗原包被的间接法直接测定IgM抗体,因标本中一般同时存在较高浓度的IgG抗体,后者将竞争结合固相抗原而使一部份IgM抗体不能结合到固相上。因此如用抗人IgM作为二抗,间接测定IgM抗体,必须先将标本用A蛋白或抗IgG抗体处理,以除去IgG的干扰。在临床检验中测定抗体IgM时多采用捕获包被法。先用抗人IgM抗体包被固相,以捕获血清标本中的IgM(其中包括针对抗原的特异性IgM抗体和非特异性的IgM)。然后加入抗原,此抗原仅与特异性IgM相结合。继而加酶标记针对抗原的特异性抗体。再与底物作用,呈色即与标本中的IgM成正相关。此法常用于病毒性感染的早期诊断。甲型肝炎病毒(HAV)抗体的检测模式见图2-7。
类风湿因子(RF)同样能干扰捕获包被法测定IgM抗体,导致假阳性反应。因此中和IgG的间接法近来颇受青睐,用这类试剂检测抗CMV IgGM和抗弓形虫IgM抗体已获成功。
2.2.7 ABS-ELISA法
ABS为亲和素(avidin)生物素(biotin)系统(system)的略语。亲和素是一种糖蛋白,分子量60000,每个分子由4个能和生物素结合的亚基组成。生物素为小分子化合物,分子量244。用化学方法制成的衍生物素-羟基琥珀酰亚胺酯可与蛋白质和糖等多种类型的大小分子形成生物素标记产物,标记方法颇为简便。生物素与亲和素的结合具有很强的特异性,其亲和力较抗原抗体反应大得多,两者一经结合就极为稳定。由于一个亲和素可与4个生物素分子结合,因此如把ABS与ELISA法可分为酶标记亲和素-生物素(LAB)法和桥联亲和素-生物素(ABC)法两种类型。两者均以生物素标记的抗体(或抗原)代替原ELISA系统中的酶标抗体(抗原)。在LAB中,固相生物素先与不标记的亲和素反应,然后再加酶标记的生物素以进一步提高敏感度。在早期,亲和素从蛋清中提取,这种卵亲和素为碱性糖蛋白,与聚苯乙烯载体的吸附性很强,用于ELISA中可使本底增高。从链霉菌中提取的链霉亲和素则无此缺点,在ELISA应用中有替代前者的趋势。由于ABS-ELISA较普通
ELISA多用了两种试剂,增加了操作步骤,在临床检验中ABS-ELISA应用不多。
科研项目中检测微量的成分如细胞因子常采用本法。
晶美分装ELISA KIT采用的方法:
- TORCH及传染病试剂盒(间接法),见2.2.3
- TORCH-IgM捕获法
特色:包被抗体,标记抗原
原理:
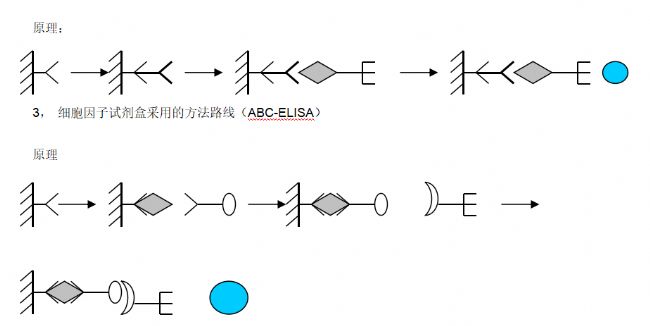
产品特色:采用ABC法,灵敏度更高,特异性更强。
生物素抗体和酶联物是浓缩的,使用前需用相应的缓冲液稀释。酶联物可以通用。
3、ELISA的试剂
在临床检验中一般采用商品试剂盒进行测定。前文(2.2)已述,ELISA中有三个必要的试剂:免疫吸附剂、结合物和酶的底物等。完整的ELISA试剂盒包含以下各组分:
(1)已包被抗原或抗体的固相载体(免疫吸附剂);
(2)酶标记的抗原或抗体(结合物);
(3)酶的底物;
(4)阴性对照品和阳性对照品(定性测定中),参考标准品和控制血清(定量测定中);
(5)酶联物(结合物)及标本的稀释液;
(6)洗涤液;
(7)酶反应终止液。
3.1 免疫吸附剂
已包被抗原或抗体的固相载体在低温(2~8℃)干燥的条件下一般可保存6个月以上。有些不完整的试盒,仅供应包被用抗原或抗体,检测人员需自行包被。以下简述固相载体和包被过程。
3.1.1 固相载体
固相载体在ELISA测定过程中作为吸附剂和容器,不参与化学反应。可作ELISA中载体的材料很多,最常用的是聚苯乙烯。聚苯乙烯具有较强的吸附蛋白质的性能,抗体或蛋白质抗原吸附其上后仍保留原来的免疫学活性,加之它的价格低廉,所以被普遍采用。聚苯乙烯为塑料,可制成各种形式。
ELISA载体的形状主要有三种:微量滴定板、小珠和小试管。以微量滴定板最为常用,专用于EILSA的产品称为ELISA板,国际上标准的微量滴定板为8×12的96孔式。为便于作少量标本的检测,有制成8联孔条或12联孔条的,放入座架后,大小与标准ELISA板相同。ELISA板的特点是可以同时进行大量标本的检测,并可在特制的比色计上迅速读出结果。现在已有多种自动化仪器用于微量滴定板型的ELISA检测,包括加样、洗涤、保温、比色等步骤,对操作的标准化极为有利。聚苯乙烯经射线照射后,其吸附性能特别是对免疫球蛋白的吸附性能增加,应用于双抗体夹心法可使固相上抗体量增多,但用于间接法测抗体时空白值较大。
良好的ELISA板应该是吸附性能好,空白值低,孔底透明度高,各板之间、同一板各孔之间、同一板各孔之间性能相近。聚苯乙烯ELISA板由于原料的不同和制作工艺的差别,各种产品的质量差异很大,因此,每一批号的ELISA板在使用前须事先检查其性能。常用的检查方法为:以一定浓度的人IgG(一般为10ng/ml)包被ELISA板各孔,洗涤后每孔内加入适当稀释度的酶标抗人IgG抗体,保温后洗涤,加底物显色,终止酶反应后,分别测每孔溶液的吸光度。控制反应条件,使各孔读数在吸光度0.8左右。计算全部读数的平均值。所有单个读数与全部读数的均数之差,应小于10%。
与聚苯乙烯类似的塑料是聚氯乙烯。作为ELISA固相载体,聚氯乙烯的特点为质软板薄,可剪割,价廉,但光洁度不如聚苯乙烯板,孔底亦不如聚苯乙烯平整。聚氯乙烯对蛋白质的吸附性能比聚苯乙烯高,但空白值也略高。
为比较不同固相在某一ELISA测定中的优劣,可应用如下的试验:用其他免疫学测定方法选出一个典型的阳性标本和阴性标本,将它们进行一系列稀释后,在不同的固相载体上按预定的ELISA操作步骤进行测定,然后比较结果。在哪一种载体上阳性结果与阴性结果差别最大,这种载体就是这一ELISA测定项目的最合适的固相载体。
在ELISA中,用作固相载体的小珠一般为直径0.6cm的圆珠,表面经磨砂处理后吸附面积大大增加。ELISA板孔的吸附面积约为200mm2,小珠均为1000mm2,将近ELISA板孔的5倍。吸附面积的增大即意味着固相抗原或抗体量的增加。再者,球型小珠的表面弧度更有利于吸附的抗原决定簇或抗体结合位点的暴露面处于最佳反应状态,因此珠式ELISA的反应往往更为灵敏。小珠的另一特点是更易于使洗涤彻底,使用特殊的洗涤器,使小珠在洗涤过程中滚动淋洗,其洗涤效果远较板孔的浸泡式为好。但由于磨砂工艺的难度较大,小珠的均一性较差。
小试管作为固相载体也有较大的吸附表面,而且标本的反应量也相应增加。板式及珠式ELISA的标本量一般为00-200ul,而小试管可根据需要加大反应体积,标本反应量的增加有助于试验敏感性的提高。小试管还可以当作比色杯,最后直接放入分光光度计中比色。
也有应用聚苯乙烯胶乳或其他材料制成的微粒作为ELISA固相载体的。其优点是表面积极大,反应在悬液中进行,其速率与液相反应近似。以含铁的磁性微粒作为ELISA固相载体,反应后用磁铁的吸引进行分离,洗涤方便,试剂盒一般均配以特殊仪器。
3.1.2 包被的方式
将抗原或抗体固定在过程称为包被(coating)。换言之,包被即是抗原或抗体结合到固相载体表面的过程。蛋白质与聚苯乙烯固相载体是通过物理吸附结合的,靠的是蛋白质分子结构上的疏水基团与固相载体表面的疏水基团间的作用力。这种物理吸附是非特异性的,受蛋白质的分子量、等电点、浓度等的影响。载体对不同蛋白质的吸附能力是不相同的,大分子蛋白质较小分子蛋白质通常含有更多的疏水基团,故更易吸附到固相载体表面。IgG对聚苯乙烯等固相具有较强的吸附力,其联结多发生在Fc段上,抗体结合点暴露于外,因此抗体的包被一般均采用直接吸附法。蛋白质抗原大多也可采用与抗体相似的方法包被。当抗原决定簇存在于或邻近于疏水区域时,抗原与固相载体的直接吸附可使抗原决定簇不能充分暴露,在这种情况下,直接包被效果不佳,可以采用间接的捕获包被法,即先将针对该抗原的特异抗体作预包被,其后通过抗原抗体反应使抗原固相化。此间接结合在固相上的抗原远离载体表面,其抗原决定簇也得以充分暴露。间接包被的抗原经固相抗体的亲和层析作用,包被在固相上的抗原纯度大大提高,因此含杂质较多的抗原也可采用捕获包被法(见2.2.4),试验的特异性、敏感性均由此得以改善,重复性亦佳。间接包被的另一优点是抗原用量少,仅为直接包被的1/10乃至于/100。不易吸附在聚苯乙烯载体上的非蛋白质抗原可采用特殊的包被方式。例如,在检测抗DNA抗体时,需用DNA作为包被抗原,而普遍的固相载体一般不能直接与核酸结合。可将聚苯乙烯板先经紫外线照射(例如30W紫外灯,75cm照射12小时),以增加其吸附性能。固相载体先用碱性蛋白质,如聚赖氨酸、鱼精蛋白等作预包被,也可提高核酸的结合力。也可用亲和素生物素系
统作间接包被,即用亲和素先包被载体,然后加入生物素化的DNA,这种包被方法均匀、牢固,已扩大应用于各种抗原物质的定量测定。
脂类物质无法与固相载体结合,可将其在有机溶剂(例如乙醇)中溶解后加入ELISA板孔中,开盖置冰箱过夜或冷风吹干,待酒精挥发后,让脂质自然干固在固相表面。抗心磷脂抗体的ELISA试剂一般采用这种包被方式。
3.1.3 包被用抗原
用于包被固相载体的抗原按其来源不同可分为天然抗原、重组抗原和合成多肽抗原三大类。天然抗原可取自动物组织、微生物培养物等,须经提取纯化才能作包被用。如HBsAg可以从携带者的血清中提取,一般的细菌和病毒抗原可以从其培养物中提取,蛋白成份抗原可从富含此抗原的材料中提取等(例如AFP从脐带血或胎肝中提取)。重组抗原是抗原基因在质粒体中表达的蛋白质抗原,多以大肠杆菌或酵母菌为质粒体。重组抗原的优点是除工程菌成份外,其他杂质少,而且无传染性,但纯化技术难度较大。以大肠杆菌为质粒体的重组抗原如不能充分除大肠杆菌成份,用于ELISA,在反应中可出现假阳性,因不少受检者受大肠杆菌感染而在血清中存在抗大肠杆菌抗体。重组抗原的另一特点是能用基因工程制备某些无法从天然材料中分离的抗原物质。例如丙型肝炎病毒(HCV)尚不能培养成功,而且丙肝病人血清中HCV抗原含量极微。目前检测抗HCV ELISA中所用包被抗原大多为根据HCV的基因克隆表达而制备的重组抗原。在传染病诊断中,不少重组抗原如HBsAg、HBeAg和HIV抗原等均在ELISA中取得应用。合成多肽抗原是根据蛋白质抗原分子的某一抗原决定簇的氨基酸序列人工合成的多肽片段。多肽抗原一般只含有一个抗原决定簇,纯度高,特异性也高,但由于分子量太小,往往难于直接吸附于固相上。多肽抗原的包被一般需先使其与无关蛋白质如牛血清白蛋白质(BSA)等偶联,借助于偶联物与固相载体的吸附,间接地结合到固相载体表面。应用多肽抗原的另一注意点为他仅能检测与其相应的抗体。一种蛋白质抗原往往含有多个不同的能引起抗体产生的决定簇,因此在受检血清中的其他抗体就不能与该多肽抗原发生反应。另外,某些微生物发生变异时往往发生抗原结构变化,在这种情况下,用个别多肽抗原进行包被可引起其他抗体的漏检。
3.1.4 包被用抗体
包被固相载体的抗体应具有高亲和力和高特异性,可取材于抗血清或含单克隆抗体的腹水或培养液。如免疫用抗原中含有杂质(即便是极微量的),在抗血清中将出现杂抗体,必须除去(可用吸收法)后才能用于ELISA,以保证试验的特异性。抗血清不能直接用于包被,应先提取IgG,通常采用硫酸铵盐析和Sephadex凝胶过滤法。一般经硫酸铵盐析粗提的IgG已可用于包被,高度纯化的IgG性质不稳定。如需用高亲和力的抗体包被以提高试验的敏感性,则可采用亲和层析法以除去抗血清中含量较多的非特异性IgG。腹水中单抗的浓度较高,特异性亦较强,因此不需要作吸收和亲和层析处理,一般可将腹水作适当稀释后直接包被,必要时也可用纯化的IgG。应用单抗包被时应注意,一种单抗仅针对一种抗原决定簇,在某些情况下,用多种单抗混合包被,可取得更好的效果。
3.1.5 包被的条件
包被用抗原或抗体的浓度,包被的温度和时间,包被液的pH等应根据试验的特点和材料的性质而选定。抗体和蛋白质抗原一般采用pH9.6的碳酸盐缓冲液作为稀释液,也有用pH7.2的磷酸盐缓冲液及pH7~8的Tris-HCL缓冲液作为稀释液的。通常在ELISA板孔中加入包被液后,在4-8℃冰箱中放置过夜,37℃中保温2小时被认为具有同等的包被效果。包被的最适当浓度随载体和包被物的性质可有很大的变化,每批材料需通过实验与酶结合物的浓度协调选定。一般蛋白质的包被浓度为100ng/ml-20ug/ml。
3.1.6 封闭
封闭(blocking)是继包被之后用高浓度的无关蛋白质溶液再包被的过程。抗原或抗体包被时所用的浓度较低,吸收后固相载体表面尚有未被占据的空隙,封闭就是让大量不相关的蛋白质充填这些空隙,从而排斥在ELISA其后的步骤中干扰物质的再吸附。封闭的手续与包被相类似。最常用的封闭剂是0.05%-0.5%的牛血清白蛋白,也有用10%的小牛血清或1%明胶作为封闭剂的。脱脂奶粉也是一种良好的封闭剂,其最大的特点是价廉,可以高浓度使用(5%)。高质量的速溶食用低脂奶粉即可直接当作封闭剂使用,但由于奶粉的成份复杂,而且封闭后的载体不易长期保存,因此在试剂盒的制备中较少应用。
封闭是否必要,取决于ELISA的模式及具体的实验条件。并非所有的ELISA固相均需封闭,封闭不当反而会使阴性本底增高。一般说来,双抗体夹心法,只要酶标记物是高活性的,操作时洗涤彻底,不经封闭也可得到满意的结果。特别是用单抗腹水直接包被时,因其中大量非抗体蛋白在包被时同样也吸附在固相表面,业已起到了类似封闭剂的作用。但在间接法测定中,封闭一般是不可少的(见2.2.2)。包被好的ELISA板干燥后放入密封袋或锡袋中,在低温可保存数月。
3.2 酶联物(结合物)
结合物即酶标记的抗体(或抗原),是ELISA中最关键的试剂。良好的结合物应该是既保有酶的催化活性,也保持了抗体(或抗原)的免疫活性。结合物中酶与抗体(或抗原)之间有恰当的分子比例,在结合试剂中应尽量不含有或少含有游离的(未结合的)酶或游离的抗体(或抗原)。此外,结合物尚要有良好的稳定性。
3.2.1酶
用于ELISA的酶应符合以下要求:纯度高,催化反应的转化率高,专一性强
