
期刊:nature communication
影响因子:14.9
主要技术:单细胞转录组
导语
急性髓系白血病(AML)的微环境在不同亚型中展现出细胞和分子层面的显著差异。本研究中,我们采用单细胞RNA测序技术(scRNA-seq)对儿童AML患者的骨髓样本进行分析,这些样本分别来自诊断(Dx)、诱导治疗结束(EOI)和复发阶段。通过对Dx和EOI阶段的scRNA-seq数据以及TARGET AML项目的RNA-seq数据集进行深入分析,我们识别出7个与AML细胞密切相关的基因:CLEC11A、PRAME、AZU1、NREP、ARMH1、C1QBP和TRH。此外,我们还在一个独立的数据集中验证了这一基因特征集的准确性和可靠性。我们深度分析了在诊断(Dx)阶段,与复发和持续完全缓解(CCR)相关的急性髓系白血病(AML)细胞展现出不同的细胞簇特征,以及与患者生存预后相关的差异表达基因。具体来说,在诊断(Dx)阶段,复发风险较高的样本中耗竭T细胞的数量较多,而与CCR相关的样本中则显示出较多炎性M1型巨噬细胞。治疗结束后,在诱导结束(EOI)阶段残留的急性髓系白血病细胞中,我们观察到脂肪酸氧化、肿瘤生长和干细胞相关基因的表达上调。此外,与复发样本相关的治疗后T细胞簇表现出MHC I类分子和T细胞调节基因表达的下调。本研究为儿童AML复发和CCR相关样本进行了详细的描述,进一步深化了我们对骨髓(BM)微环境状态的理解。
文章亮点
1.文章利用单细胞RNA测序技术对儿童急性髓系白血病(AML)的骨髓样本进行了分析,这使得研究者能够深入了解疾病在不同阶段的细胞和分子差异。
2.基因标志物的发现:研究者识别出一个与AML相关的7个基因标志物(CLEC11A, PRAME, AZU1, NREP, ARMH1, C1QBP, TRH),这一发现有助于区分AML细胞。
主要技术
单细胞转录组
研究思路
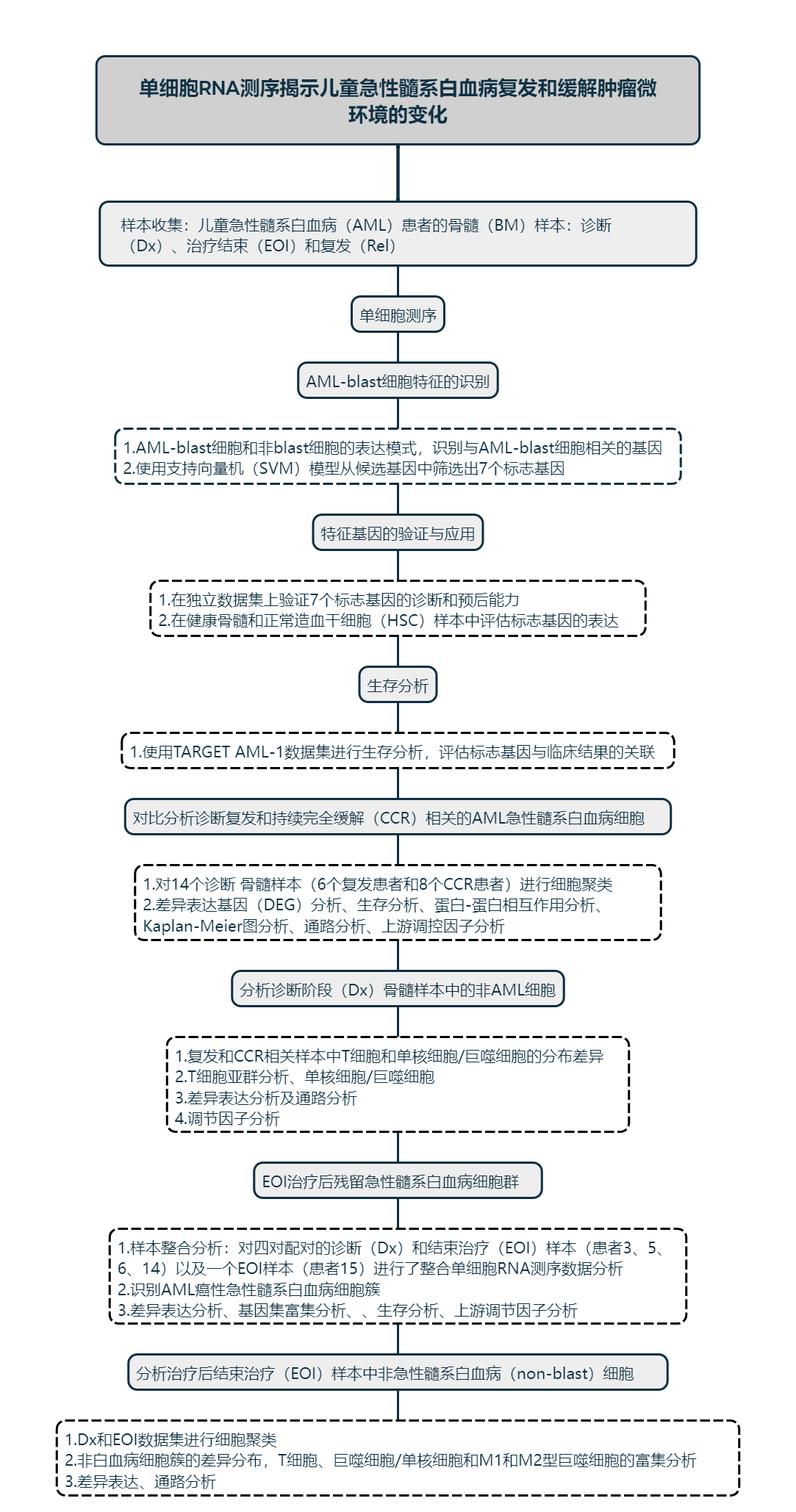
研究结果
1.临床样本和研究设计
从亚特兰大儿童保健中心(CHOA)获得的冷冻骨髓(BM)样品,使用10x平台进行了单细胞转录组测序。共有20例患者的31个骨髓(BM) 样本。在31个 BM 样品中,19个诊断(Dx) (1D-14D,16D-20D),10个诱导结束(EOI )(3E,5E,6E,14E-20E),2个复发(Rel)(5R,6R)。因此,有9对配对的 Dx 和 EOI 样品,其中4个用于开发7个基因标志物(患者3,5,6和14) ,5个用于验证7个基因标志物(患者16-20)。两名患者(5和6)在诊断(Dx),诱导结束(EOI)和复发(Rel)采集样本。
2.单细胞分析鉴定了分化细胞和异质性患者特异性 AML 急性髓系白血病细胞
对来自四个配对的诊断(Dx),诱导结束(EOI)样品(患者3,5,6,14)的scRNA-seq 数据进行比较分析。经过质控之后,对19,350个细胞进行无监督分析聚类为14个细胞簇(图1a)。根据分化免疫细胞和基质细胞的marker基因的表达,对其中 11 个簇进行手动注释(图1b),其他细胞群被推定为急性髓系白血病细胞簇(图1b)。分化的免疫细胞包括 T 细胞、B 细胞 、单核细胞 、巨噬细胞、单核细胞/巨噬细胞、浆细胞样树突状细胞、前 B/浆细胞和中性粒细胞 (图1b)。这些急性髓系白血病细胞簇具有患者特异性,反映了急性髓系白血病细胞之间的异质性(图1c)。UMAP分析显示,三个典型急性髓系白血病细胞簇在Dx样本中过度表达,EOI样本中有更多的分化细胞(图1d)。
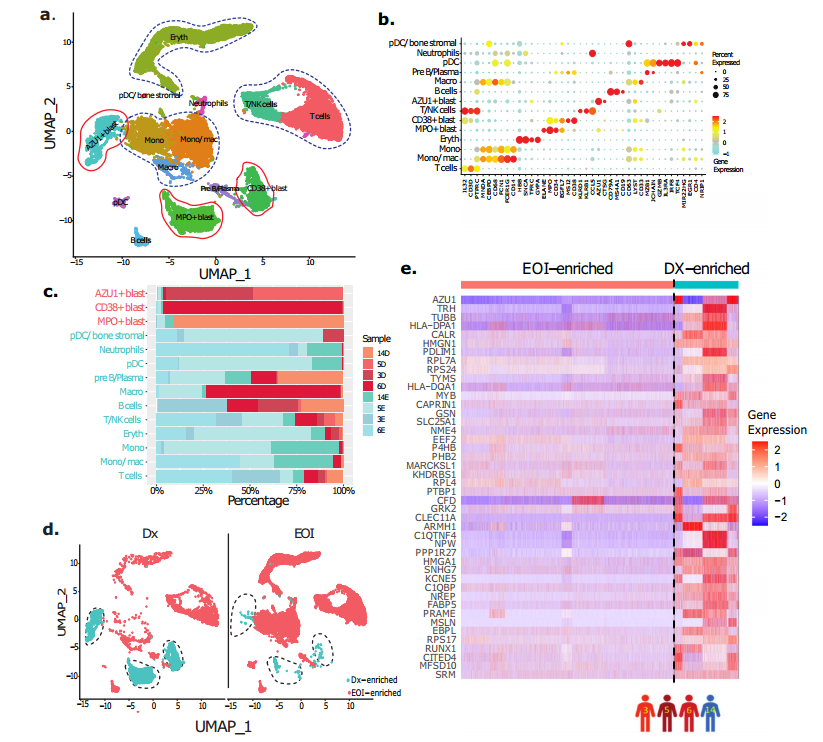
图1 单细胞转录组识别AML中异质性的急性髓系白血病细胞簇
3. AML急性髓系白血病细胞特征的鉴定
成功区分急性髓系白血病(AML)细胞和非急性髓系白血病细胞簇之后,我们利用来自四名患者(3、5、6和14)的配对诊断(Dx)和诱导结束(EOI)样本的整合单细胞RNA测序(scRNA-seq)数据,开发出特异性针对AML细胞的基因集。我们对Dx阶段富集的AML细胞簇(表现为MPO+、CD34+、AZU+)与EOI阶段富集的非非急性髓系白血病细胞簇(分别对应Dx和EOI时间点)进行了差异表达基因(DEG)分析(图1d),并鉴定出232个显著的DEGs。
为了进一步筛选和细化这一基因列表,我们引入了TARGET AML-1数据集,该数据集包含了不同急性髓系白血病细胞比例的Dx骨髓样本以及治疗后的EOI骨髓样本。在TARGET AML-1的Dx样本中,根据疾病负担的程度,我们将样本分为三个区间:超过60%、30-60%、低于30%的急性髓系白血病细胞比例。与EOI样本相比较,我们发现在高急性髓系白血病细胞比例样本(超过60%)和低急性髓系白血病细胞比例样本(低于30%)中,共有44个基因显著过表达。随后,我们对患者3、5、6、14的scRNA-seq数据进行了基因表达分析,确认这44个基因在AML细胞中具有特异性,与EOI阶段的非急性髓系白血病细胞相比,在Dx阶段的AML急性髓系白血病细胞中表达水平更高(见图1e)。
在 44 个基因中,选择了 20 个在 Dx AML 细胞中表现出特异性过表达的基因(与治疗后非AML细胞相比)进行进一步评估。与 TARGET AML-1 数据集中 <30% 的急性髓系白血病细胞和 EOI 样本相比,所选 20 个基因在 >60% 和 30-60% 的急性髓系白血病细胞样本中的表达更高(图 2a)。这些在急性髓系白血病细胞中过表达的基因包括与抗凋亡相关的基因(如PRAME、MSLN、CITED4)、造血前体细胞生长因子(如CLEC11A)、细胞增殖相关基因(如CAPRIN1),以及PPARα诱导的增殖和肿瘤生长相关基因(如FABP5)。NREP和CLEC11A两个基因被确认与AML急性髓系白血病细胞密切相关。在配对的Dx和EOI样本中鉴定的三个急性髓系白血病细胞簇中,这两个急性髓系白血病细胞相关基因(NREP和CLEC11A)显示出高表达(图2b),其表达水平相当于或优于目前临床上用于鉴定AML急性髓系白血病细胞的基因(如CD34、MPO、CD33和CD56/NCAM1)。
尽管在急性髓系白血病细胞比例大于60%和30-60%的Dx样本中,这20个基因的表达差异不大,但与急性髓系白血病细胞比例低(小于30%)和治疗后EOI样本相比,差异更为显著(图2a、c)。此外,在20个AML细胞相关基因中,大多数(14个)在TARGET AML-1数据集中与总体生存率(OS)显示出显著相关性(见图2d)。
为了更精确地区分AML急性髓系白血病细胞和其他细胞,我们采用了监督机器学习方法——支持向量机(SVM)。SVM分析鉴定出7个基因(CLEC11A、PRAME、AZU1、NREP、ARMH1、C1QBP、TRH),它们能够以0.968的AUC值区分AML相关的急性髓系白血病细胞和非急性髓系白血病细胞(见图2e)。这一发现为AML的诊断和治疗提供了新的分子标记。
基于7个基因特征的模块评分有效地区分了潜在的AML急性髓系白血病细胞与非急性髓系白血病细胞。急性髓系白血病细胞簇 (MPO+ 和 AZU1+ ) 在 Dx (5D, 6D) 和 Rel (5R, 6R) 样本中占主导地位,而在 EOI (5E, 6E) 样本中则最少 (图 2f, g)。接下来,我们评估了AML急性髓系白血病细胞相关7个基因特征在区分急性髓系白血病细胞与正常HSC和健康BM样本中的特异性。我们通过整合多个数据集,包括AML患者的诊断和结束治疗样本、健康成年人的骨髓单细胞RNA测序数据以及公开的造血干细胞数据集,利用7个基因特征对AML急性髓系白血病细胞进行了特异性分析。结果展示MPO+,AZU+,CD38+这些基因在AML急性髓系白血病细胞中的显著表达(图2h),模块评分显示AML急性髓系白血病细胞与非急性髓系白血病细胞以及健康对照样本之间的显著差异(图2I),突出了7个基因特征在识别和区分AML急性髓系白血病细胞中的潜力。这些结果不仅证实了7个基因特征的特异性,也为AML的诊断和治疗提供了新的分子标记。
为了进一步验证7个特征基因在区分急性髓系白血病细胞与非急性髓系白血病细胞方面的性能,我们分析了两个独立的scRNA-seq数据集。数据集一由来自另外5名急性白血病患者(患者16-20)的配对Dx和EOI样本组成。UMAP揭示了Dx富集的集群(0、2、5、6、10、11、13、14、17),这些集群在治疗后EOI样本中急剧减少。对7个特征基因进行的基于SVM的分析,用于区分AML急性髓系白血病细胞与非急性髓系白血病细胞,其结果为0.78(图2 j)。第二个数据集包含八名儿童AML患者的样本,通过整合分析和额外的CNA分析,我们成功识别出AML急性髓系白血病细胞簇,并得到0.809的AUC值(图2k)。这些高AUC值进一步证实了7个特征基因在AML急性髓系白血病细胞特异性中的有效性。
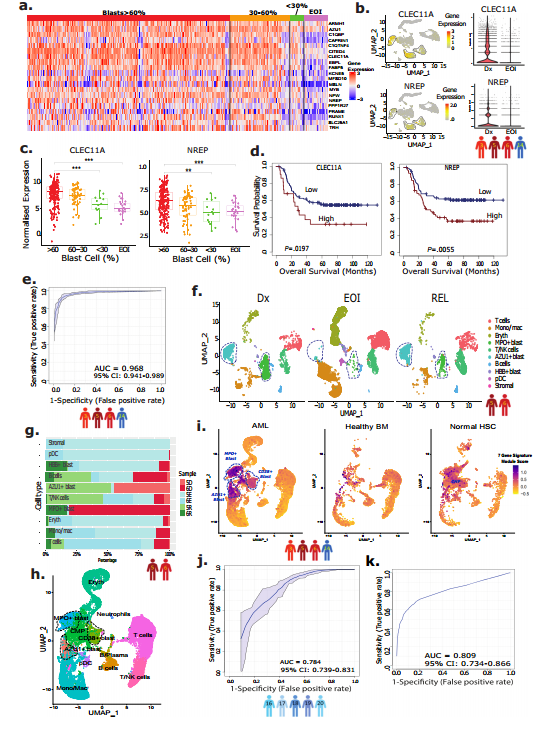
图2 从异质性AML急性髓系白血病细胞中开发出急性髓系白血病细胞前体特征标记
4.对比分析诊断复发和持续完全缓解(CCR)相关的AML急性髓系白血病细胞
为了深入分析诊断阶段的AML急性髓系白血病细胞和免疫细胞的特征,我们对14个在诊断时收集的骨髓样本进行了研究,其中包括6个复发患者的样本(编号1D至6D)和8个持续完全缓解(CCR)患者的样本(编号7D至14D)。经过严格的质量控制、数据处理和标准化流程后,我们对28,181个细胞聚类为15个细胞簇。利用基于7个基因的急性髓系白血病细胞特征模块评分系统,我们鉴定出14,166个细胞为AML急性髓系白血病细胞,这些细胞主要分布在第1、3、5、9、10、12、13簇中。而其余的14,015个细胞则被归类为非急性髓系白血病细胞簇。
为了深入探究AML急性髓系白血病细胞的特性,我们对这些细胞进行了筛选和重新聚类。通过UMAP分析,我们发现无论是复发还是持续完全缓解(CCR)的急性髓系白血病细胞,在转录层面上都展现出较高的相似性(见图3a)。在AML患者中,不同患者的急性髓系白血病细胞基因表达模式存在显著的异质性(见图3b)。与CCR相关的细胞簇(第1、3、4簇)和与复发相关的细胞簇(第0、2、7、13簇)在差异表达基因(DEG)分析中具有较大的差异。与CCR相关的细胞簇中,MPO、IFITM3、TRH、PRTN3和HLA-DPA1等基因表达水平较高,而与复发相关的细胞簇中,CRIP1、FLNA和RFLNB/FAM101B等基因表达水平升高(图3c)。生存分析显示,复发相关细胞簇中过表达的FLNA和RFLNB/FAM101B基因与较差的总生存(OS)显著相关(见图3d)。相对地,CCR相关细胞簇中过表达的基因,例如MPO和TRH,与较好的OS显著相关(图3d)。
基于已知和预测的蛋白-蛋白相互作用的交互式弦网络分析,我们识别出FLNA作为RFLNB/FAM101B的关键相互作用蛋白。另一个被识别的RFLNB/FAM101B的相互作用蛋白是WDFY4,它在调节经典树突状细胞介导的病毒和肿瘤抗原交叉呈递中发挥着关键作用。Kaplan-Meier图显示,RFLNB/FAM101B和WDFY4基因的高表达与较差的OS和较短的无事件生存期(EFS)显著相关。此外,对复发相关Dx急性髓系白血病细胞DEGs的通路分析揭示了包括“RhoGDI信号”、“eNOS信号”、“雄激素信号”和“蛋白激酶A信号”在内的多个通路的显著激活(P<0.01)(图3e)。这些复发相关急性髓系白血病细胞中JAK/STAT信号、HIF1-α、干扰素和神经炎症信号相关的通路被显著抑制(图3e)。进一步的基于上游调控因子的系统生物学分析发现,在复发相关的急性髓系白血病细胞中,一个与细胞生长和增殖相关的主调控因子(如MTA1, NKX2.3, TCF3)的内聚网络被激活(见图3f)。
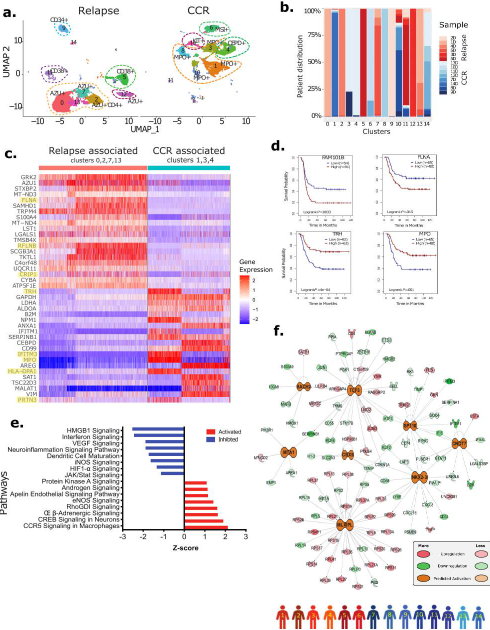
图3 复发样本的AML急性髓系白血病细胞转录与CCR样本具有差异
5.与Dx复发相关的非急性髓系白血病细胞簇,耗竭T细胞的富集和M1型巨噬细胞减少
接下来,我们对诊断Dx时骨髓样本中的非急性髓系白血病细胞进行了深入分析。UMAP揭示了复发和CCR相关样本中细胞类型(特别是T细胞和单核细胞/巨噬细胞)的分布差异(图4a)。为了了解特定亚型的T细胞是否与AML复发/CCR相关,T细胞分为11个不同的亚簇(图4c)。结果表明,AML急性髓系白血病细胞对不同的幼稚和激活T细胞亚簇具有不同反应(图4d)。幼稚T细胞(CCR7+,LEF1+,TCF7+)亚簇2、4和7显著表达细胞毒性T细胞标记物(即CD8)。亚簇5、6、9、10和11是表达CCL5、KLRB1、KLRD1、GZMH、CD69和CD44的激活T细胞簇(图4C)。复发和CCR相关样本的比较分析显示,前者的T细胞百分比显著更高(图4e)。此外,基于ssGSEA评分的T细胞耗竭估计显示,复发相关样本中耗竭T细胞的比例显著高于CCR相关样本(图4e)。在CCR相关的T细胞亚群中观察到更多显著的幼稚T细胞(CCR7,LEF1,TCF7)(图4e)。对包含复发相关亚簇(3,5,6)和CCR相关亚簇(7,8,10)进行DEGs分析(图4f)。复发相关簇的上调DEGs的通路分析显示多个免疫调节通路的显著上调,包括Th1通路、钙诱导的T淋巴细胞凋亡,以及T细胞耗竭通路的上调和PD-1与PD-L1癌症免疫治疗通路的下调(图4g)。这些结果表明,复发和CCR相关的特定T细胞亚型的富集可能在治疗后的结果中发挥作用。
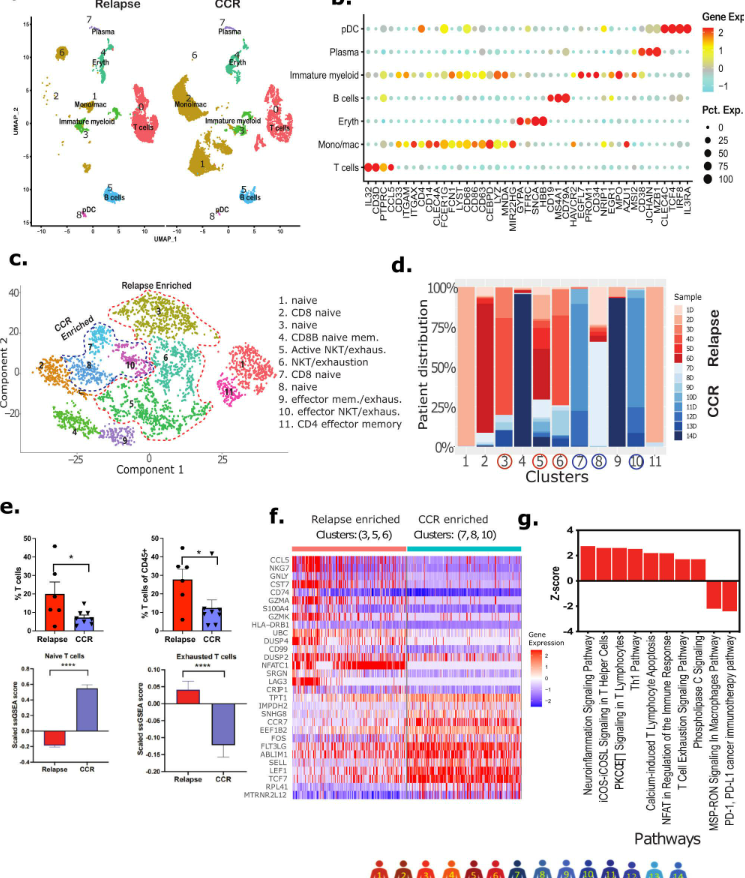
图4 Dx样品免疫微环境分析
6. CCR 相关样本中富含炎症单核细胞/巨噬细胞
对Dx非急性髓系白血病细胞(来自患者样本1-14)的集中分析确定了三种单核细胞/巨噬细胞,这些亚群在持续完全缓解(CCR)患者和复发患者的样本中比例存在显著差异(图5a)。簇1和2富集了与CCR相关的样本,而簇6仅有复发相关的样本(图5a)。与复发相关样本相比,MCR相关样本具有更多显著的M1巨噬细胞(图5 b)。在更多CCR相关样本(簇1、2)和复发相关样本(簇6)的DEGs分析中,发现前者上调了S100A炎症基因家族、蛋白酶抑制剂、CST3和先天免疫系统调节因子CTSS(图5c)。使用Dx CCR相关样本DEGs进行的基因调节因子分析显示,与M1型巨噬细胞极化相关的多个关键调节因子上调,FOS、TREM1、CD44和IL1B,以及与炎症反应相关的NFKB2被激活(图5d)。分析还识别了下调的关键调节因子,包括与AML进展相关的SAMHD1和SATB1(图5d)。SAMHD1已被证明通过抑制NF-kβ和干扰素途径在抑制先天免疫中发挥关键作用。对关键调节因子 FOS、TREM1、NFKB2 和 NFKBIA 基因表达水平的评估表明,它们在CCR相关样本中表达较高,而在复发相关样本中 CAT 和 SAMHD1 表达较高(图 5e)。
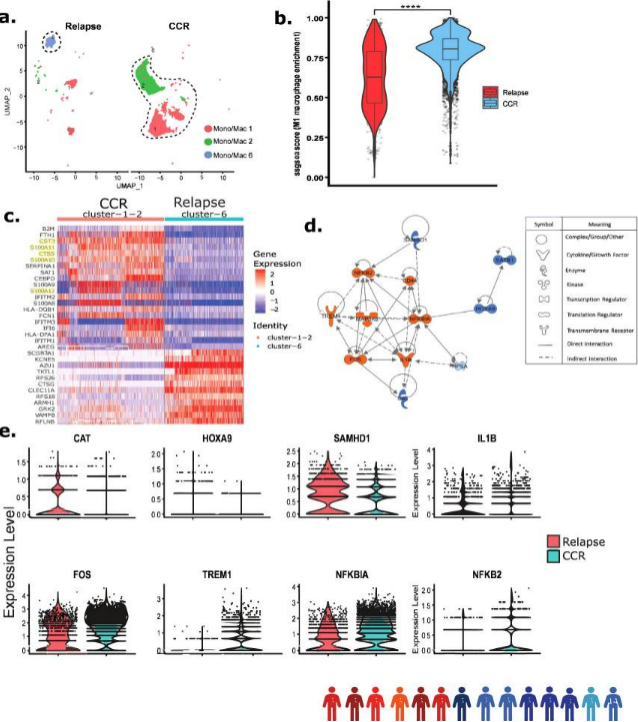
图5诊断时CCR相关样本显示炎症单核细胞/巨噬细胞富集
7. EOI治疗后残留急性髓系白血病细胞群的特征
治疗后 EOI 样本 BM 微环境的表征对于揭示临床中的急性髓系白血病细胞和非急性髓系白血病细胞状况至关重要。为了识别 EOI 残留急性髓系白血病细胞我们对四对配对的诊断(Dx)和结束治疗(EOI)样本(患者3、5、6、14)以及一个EOI样本(患者15,其Dx样本不可用)进行了整合数据分析。Dx 和 EOI 样本与 Dx 样本中富集的簇 4、6 和 8 能够很好地整合在一起(图6a)。进一步分析显示,这三个Dx富集的簇由来自各个患者的细胞组成。这些Dx富集的簇(4、6、8)表现出7个特征基因的过表达,被指定为AML癌性急性髓系白血病细胞簇。在急性髓系白血病细胞簇中观察到一小部分细胞来自EOI样本(约占Dx样本的6%)。为了确定治疗后残留肿瘤细胞的转录情况,我们对Dx急性髓系白血病细胞和治疗后EOI残留急性髓系白血病细胞进行了差异表达基因(DEGs)分析(图6b)。EOI残留急性髓系白血病细胞表现出与肿瘤生长和不良预后相关的多个基因的过表达,包括HOPX、SELENOP/SEPP1和FAM30A/C1orf110 53-55。进一步的基因集富集途径分析显示,在治疗后EOI残留急性髓系白血病细胞中,包括肌肉收缩、脂肪酸ω氧化和PPARα等多个途径显著上调(图6c)。此外,对EOI残留急性髓系白血病细胞中的DEGs进行的上游调节因子分析显示,与上皮-间充质转化相关的多个关键调节因子被激活,包括SOX4、STAT3和TGFB1(图6d)。总之,与调节治疗后EOI残留急性髓系白血病细胞的骨髓微环境相关的基因和途径的差异调控可能导致AML患者的总生存期缩短和无病生存期降低。
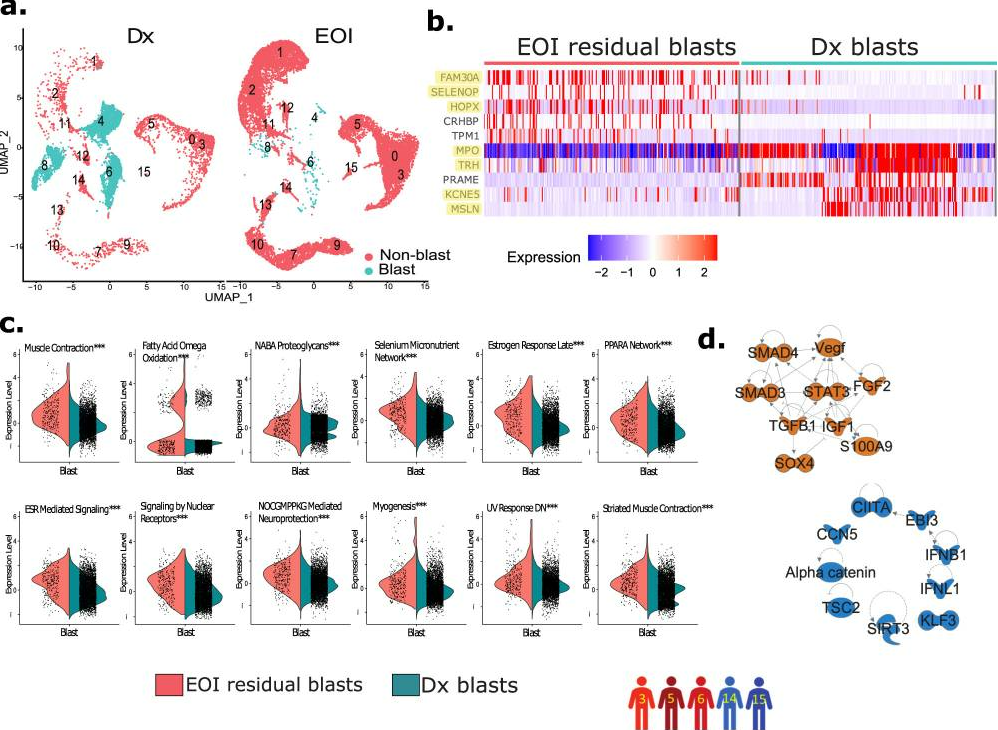
图6 结束治疗(EOI)样本的残留急性髓系白血病细胞具有不同转录特征
8.复发相关的 EOI 样本显示 T 细胞增多,单核细胞/巨噬细胞减少
为了检查EOI样本中的非急性髓系白血病细胞,我们从上述Dx、EOI数据集中单独选择了EOI样本中的细胞(15,070个单细胞),并对它们进行了重新聚类(图7a)。临床组(CCR 和复发)的典型免疫细胞(T 细胞、NK 细胞和巨噬细胞/单核细胞)的分布发生了改变(图 7a)。复发和 CCR 相关的非急性髓系白血病细胞簇在 EOI 中显示出与 Dx 中相似的模式,即复发相关样本中 T 细胞的富集程度更高,CCR 相关样本富集簇中单核细胞和巨噬细胞的比例更高(图 7b、c)。进一步的M1和M2巨噬细胞富集分析显示,在MCR EOI样本中,炎症性M1巨噬细胞占主导地位,在复发相关的EOI样本中,M2巨噬细胞明显富集(图7 d)。T细胞形成三个不同的簇,即幼稚T细胞-1、幼稚T细胞-2和NK/T细胞群(图7a)。幼稚T细胞-2簇在复发相关EOI样本中表现出显著富集(图7 e)。Th1、Th2、钙诱导的T细胞凋亡、T 辅助细胞中的 CD28 信号传导和整合素通路相关的通路下调(图 7f)。
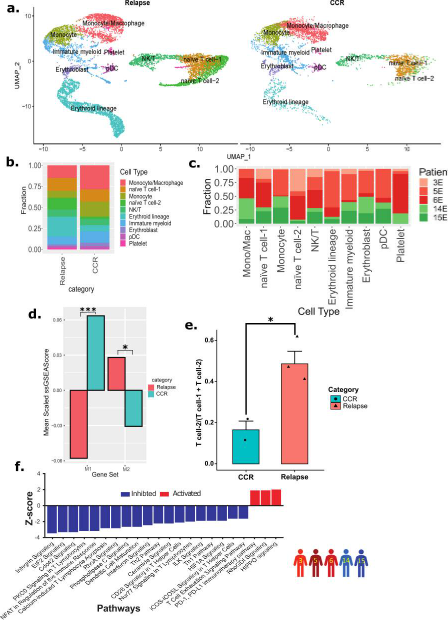
图7 EOI非急性髓系白血病细胞分析显示,复发患者和持续完全缓解(CCR)患者的样本呈现出不同的模式
参考文献:
Mumme H, Thomas BE, Bhasin SS, Krishnan U, Dwivedi B, Perumalla P, Sarkar D, Ulukaya GB, Sabnis HS, Park SI, DeRyckere D, Raikar SS, Pauly M, Summers RJ, Castellino SM, Wechsler DS, Porter CC, Graham DK, Bhasin M. Single-cell analysis reveals altered tumor microenvironments of relapse- and remission-associated pediatric acute myeloid leukemia. Nat Commun. 2023 Oct 5;14(1):6209. doi: 10.1038/s41467-023-41994-0. PMID: 37798266; PMCID: PMC10556066.
