类器官培养50问-基础篇
Q1: 类器官培养对于起始细胞的来源有要求吗?
A1: 目前培养的类器官主要来源于上皮细胞,对于非上皮细胞来源的类器官培养方式还需要进一步研究。
Q2: 类器官按照起始细胞的类型,分为几种呢?
A2: 常见的类器官根据起始细胞的类型,可以分为两种:
(1)肿瘤组织来源的肿瘤类器官;
(2)干细胞来源的类器官,包括:多能性干细胞 (PSC) /成体干细胞 (ASC)以及诱导多能干细胞(iPSC)。
Q3: 类器官是由单一种类细胞组成的吗?
A3: 类器官并不是单一细胞组成的结构,而是由具有干细胞性质的起始细胞进行分裂和分化,并将多种类型的细胞自组装的结构,自组装后的形态和功能与体内相应器官相似。
Q4:在没有新鲜组织的情况下,可以用冻存组织提取的原代细胞进行3D培养吗?
A4:可以的。已有学者验证过,将人结肠癌、甲状腺癌、肺癌、肾癌和肝癌的手术组织切碎后,以梯度降温的方式进行冷冻,最终在液氮中保存15-18个月后进行复苏和原代细胞提取,分别对细胞进行2D和3D培养,证实了冻存对于细胞活力和生长速度均无显著影响【1】。
当然,由于组织来源不同、冻存条件不同,还需要大家根据实际情况进行验证,新鲜组织提取的细胞依然是3D培养的最佳选择。
Q5:类器官可以像细胞一样进行冻存和复苏吗?
A5:类器官可以冻存,通常会在传代2-3次之后选择冻存。为了达到最佳的效果,可以选择类器官成熟(传代7-10次)后再进行冻存。
Q6:类器官的尺寸需要进行控制吗?
A6:是的,主要的原因是类器官内部缺乏循环系统。
当类器官的尺寸较大时,靠近中心的细胞难以和外界进行氧气和营养成分的交换。因此这个结构尺寸越大,死亡的细胞就越多(如图1)【2】。我们在培养的过程中,需要控制类器官的大小在4-5mm以内。未来的类器官技术可以与血管类器官结合在一起,建立一个功能性的封闭循环系统,用以培养出更大尺寸的类器官。

Q7:类器官传代的标准是什么?
A7:类器官的传代通常是根据培养的时间判断。
一般在7-14天时进行第一次传代,后续则每7-10天传代一次【3】。
Q8:类器官可以进行多少次传代?
A8:大部分类器官可以在体外连续传代10次(>6个月),甚至有些类器官可以连续传代20次(>12个月)并且维持原有的生长速度【4】。
Q9: 鉴定类器官的方法有哪些?
A9: 初步可以通过显微镜和H&E染色观察形态;然后可以用Western Blot、qRT-PCR、免疫荧光、流式细胞术检测该类器官是否表达相应的biomarker;基因测序可以鉴定所培养的类器官是否有某些特征丢失;对于部分类器官,还可以检测其是否具有功能,例如:已有研究检测出胃类器官可以分泌胃酸,心脏类器官可以自主跳动。
Q10: 类器官是如何按照我们的意愿进行定向分化的?
A10: 在进行类器官培养前,我们需要了解该器官在体内的发育过程,及早期发育相关的信号通路。
以胃类器官培养为例:胃由前后肠发育而来,早期发育需要由多种信号通路共同调控。那么在体外我们需要通过添加细胞因子的方式,指导激活/抑制相应的信号通路,来达到相同的效果,如: PSCs在Activin A的作用下分化为内胚层,Wnt3a、FGF-4和Noggin指导细胞向向前肠分化【5】。
参考文献
【1】He, A. et al. (2020). Cryopreservation of viable human tissues: Renewable resource for viable tissue, cell lines, and organoid development. Biopreservation and Biobanking, 18(3), 222-227.
【2】Lancaster, M. A. et al. (2013). Cerebral organoids model human brain development and microcephaly. Nature, 501(7467), 373-379.
【3】Sheridan, M. A. et al. (2020). Establishment and differentiation of long-term trophoblast organoid cultures from the human placenta. Nature Protocols, 15(10), 3441-3463.
【4】Beshiri, M. L. et al.(2018). A PDX/organoid biobank of advanced prostate cancers captures genomic and phenotypic heterogeneity for disease modeling and therapeutic screening. Clinical Cancer Research, 24(17), 4332-4345.
【5】McCracken, K. W. et al. (2014). Modelling human development and disease in pluripotent stem-cell-derived gastric organoids. Nature, 516(7531), 400-404
类器官培养50问-PDO篇
Q11:对于病人的肿瘤组织,需要怎样处理尽量避免污染?
A11:1、将肿瘤组织置于70%-75%乙醇中30秒,清洗表面血块等杂物,并用剪刀对组织稍加修整。
2、放入含有青/链霉素、两性霉素B、庆大霉素(单独使用某一种或几种组合)的PBS缓冲液进行进一步清洗。
3、原代细胞提取前,建议先进行支原体检测,防止支原体污染。
Q12:PDO对于药敏反应的准确度是怎样的呢?
A12:有数据表明,PDO对药敏反应的阳性预测值(预测某一特定药物有效)为88%,阴性预测值(预测某一特定药物无效)为100%,敏感性达100%,特异性为93%【1】。
Q13:病灶和癌旁培养出的类器官有差别吗?肿瘤组织的取材部位有什么要求?
A13:原发病灶和癌旁来源的肿瘤类器官是有差别的。
如:从形态上看,原发病灶来源的类器官比癌旁来源的类器官更具有侵袭性的结构【2】。
由于肿瘤具有异质性,因此类器官存在差异也是很常见的。如果想要尽量减小建模或药物筛选的误差,可以考虑多点位取材。
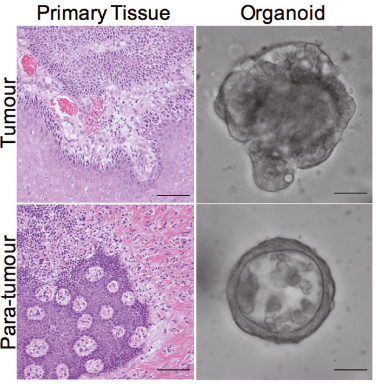
图1. 原发病灶来源的类器官比癌旁来源的类器官更具有侵袭性的结构【2】
Q14:PDO培养的成功率是多少?成功率和是否进行治疗有关系吗?
A14:不同类型来源的PDO成功率略有不同,大部分的PDO培养成功率在63%-70%左右【1】,并且临床治疗对于这个统计结果影响不大【3】。通过缩短样本离体时间和操作步骤,可以适当提高成功率。
Q15:冻存多长时间内的组织可以用于类器官培养?
A15:对于冻存在-80℃的组织,6周之内复苏并进行类器官培养是最佳选择【4】。当然如果是保存在液氮中,保存的时间可以更久一些。
Q16:原代细胞提取时,通常会混有增殖非常迅速的成纤维细胞,应该怎样快速去除呢?
A16:成纤维细胞主要有两种去除方式:
1、鉴于成纤维细胞贴壁不牢的性质,可以采用反复贴壁的方式去除大部分成纤维细胞。
2、目前已有商用的成纤维细胞去除试剂,但是否会影响类器官的培养还需要实验验证。
Q17:培养肿瘤类器官需要原始肿瘤组织的大小是多少?活检样本量足够吗?
A17:手术组织大概需要3颗黄豆大小以上,穿刺活检样本需要至少3针,内镜活检至少钳取6颗以上。
Q18:从肿瘤组织中提取原代细胞后,发现细胞呈红色,这是为什么?
A18:红色主要是由于肿瘤组织中的大量红细胞所导致的。
首先,可以在拿到组织后尽量多清洗几次,能够去除大部分的红细胞;
其次,可以使用商品化的红细胞裂解液。红细胞裂解液的原理是去除无核细胞,因此不会影响其他有核细胞的正常培养。
Q19:怎样构建含有PDO的肿瘤微环境?
A19:目前构建含有PDO的肿瘤微环境主要有三种方式:
1、将肿瘤组织经过物理或酶解分离后,在细胞外基质(Matrigel或BME)中进行类器官培养;同时分离外源性免疫细胞(通常来源于自体外周血或肿瘤组织),随后与生长的类器官进行共培养。
2、将肿瘤消化后形成的球状组织与胶原蛋白混合,并接种到微流体培养装置中,即肿瘤细胞与样本中的固有免疫微环境共同培养,形成天然TME模型。
3、将含有免疫细胞的肿瘤组织物理切割成组织碎片,在包被胶原蛋白凝胶的transwell小室中进行培养。凝胶的顶部暴露在空气中,同时外皿中的培养基通过可渗透的transwell扩散到内皿中,形成气-液交互界面(air–liquid interface, ALI)。
Q20:由于取到的肿瘤组织太小了,培养的类器官数目不足以进行后续的检测。我可以将类器官传代扩增吗?
A20:对于肿瘤来源的类器官一般是不建议传代的,因为传代后的表型会和体内情况略有差异。文献中的PDO一般会控制在2-3代【4】,最多不超过5代【5】。
如果细胞数目太少,传代5次依然不能满足测试需求,可以考虑将检测的方式改变一下,比如从96孔板换成384孔板,甚至更小体系的微流控芯片。
Q21:肿瘤组织中会存在正常细胞吗?怎么去除这些正常细胞?
A21:即使是肉眼判断为肿瘤的组织中,也会混有一部分正常细胞。因此在进行类器官培养前,可以先将原代细胞进行流式分选或磁珠分选,得到肿瘤细胞再进行类器官培养。
Q22:正常细胞是否也会生长为类器官?肿瘤类器官培养时怎么去除正常类器官?
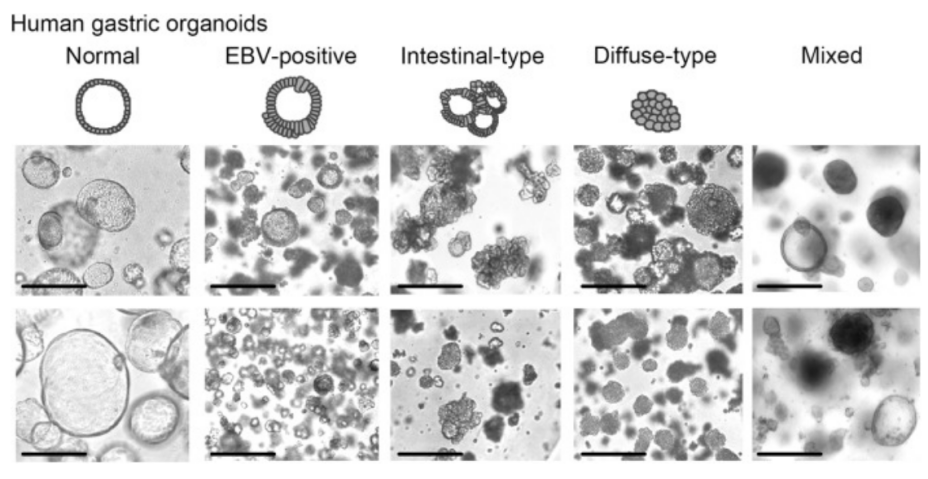
A22:由于肿瘤组织中通常混有一些健康细胞,因此培养出的肿瘤类器官很有可能混杂了来源于正常上皮的类器官。为了得到更纯的PDO,除了Q1中提到的对原代细胞进行处理外,也可以对类器官群进行“纯化”,主要有一下三种途径【6】。
1、利用正常类器官和PDO的形态不同,在镜下进行手动筛选。图1展示了胃类器官和肿瘤类器官的形态差异:正常的胃类器官呈球形,由单层上皮细胞组成,具有较大的管腔;而肿瘤类器官通常是囊状,且有多层细胞形态。
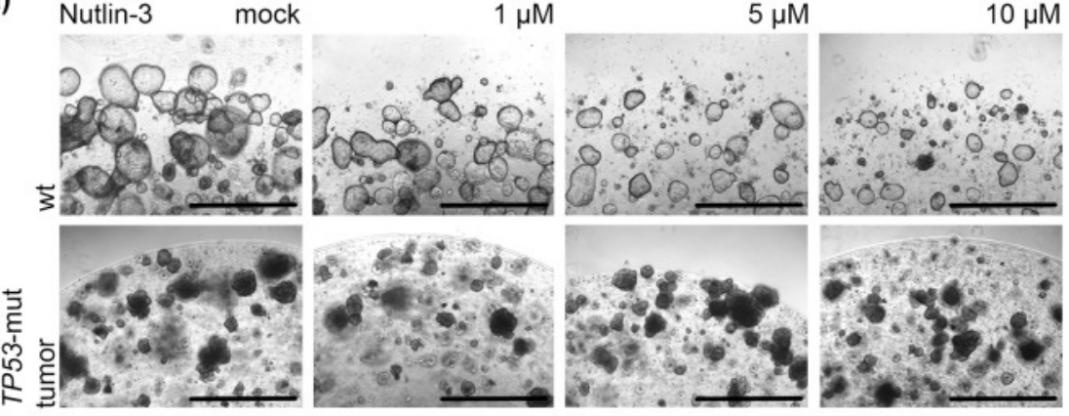
2、通过调节培养基中的组分进行筛选。如:大多数胃癌表现出TP53突变,这一突变使PDO表现出对Nutlin-3更耐受,而正常类器官则会死亡。
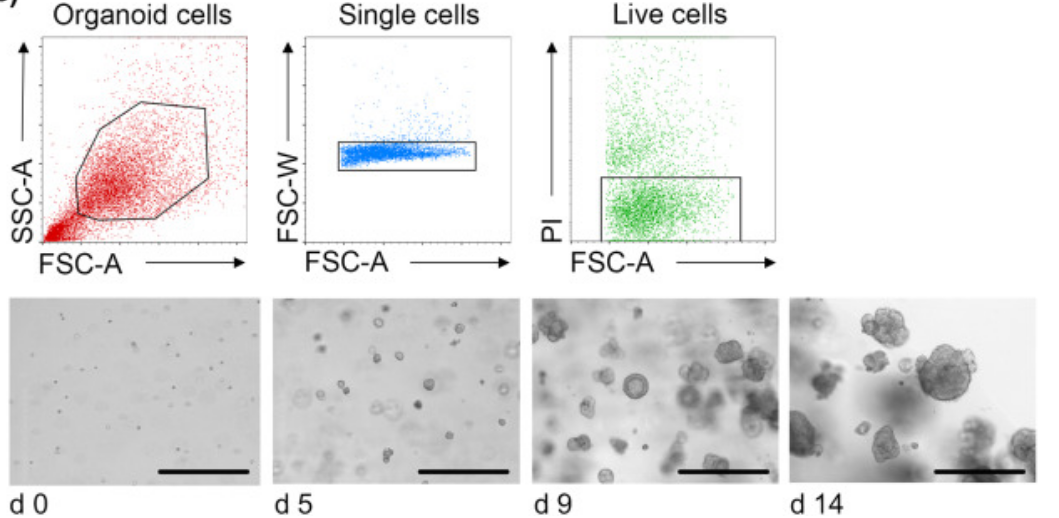
3、将类器官消化为单个细胞后,流式分选出肿瘤细胞。
Q23:进行药敏实验时,需要将PDO从基质胶中消化下来吗?
A23:可能有很多小伙伴担心基质胶会阻碍药物进入到PDO中,但无数实验已经证明,基质胶内的PDO是可以对药物进行响应的;而且PDO需要三维结构才能模拟体内状况,如果没有了基质胶的支撑,药敏实验的准确性会打折扣。
Q24:PDO实验可以代替动物模型(PDX)吗?
A24:PDO相较于动物模型有很多优点,例如成本低、耗时短、可以进行大规模培养和实验等。不过在药物代谢、癌症的浸润、转移等方向的研究则需要动物实验来进行。
Q25:在培养过程中,PDO生长情况与之前相比异常,主要表现为生长周期变短,增殖迅速,这是什么原因?
A25:如果PDO在培养过程中突然增殖迅速,可能是某些杂质细胞(如成纤维细胞)的大量生长导致的,此时最好进行切片染色,观察一下是否存在这些细胞的污染。如果不是这个原因,则考虑是突变引起的,最好进行测序验证并与初代PDO进行比对。
Q26:怎样检测PDO对药物的敏感性?
A26:主要有两种途径进行检测。
1、进行细胞活力检测,即线粒体呼吸(耗氧率)、糖酵解 (H+浓度)等;
2、可以通过高内涵成像技术进行分析。
Q27:PDO和肿瘤原代细胞的药敏实验浓度范围相同吗?
A27:小编查阅了大量的相关文献,发现PDO的药物测试有效浓度会整体高于2D细胞,不同种类的PDO之间也存在很大的倍数差异。
Q28:PDO模型可以进行抗体类药物筛选吗?
A28:由于抗体类药物需要免疫细胞的参与,因此单纯的PDO模型并不适合。可以考虑在PDO的基础上建立肿瘤微环境(TME),从而进行抗体类药物的测试。
Q29:肿瘤细胞系(如Hela细胞系)可以培养成为PDO吗?
A29:不可以。PDO需要依赖多种细胞在体外的自组装形成,而肿瘤细胞系没有自组装的能力,可能会形成细胞团,但这并不是PDO。
Q30:PDO可以进行建库吗?
A10:不论是原发型还是转移型肿瘤,都可以建立PDO样本库。但考虑到PDO的培养并不是百分之百成功的(比如CRC-PDO的培养成功率大约是73%【7】),因此建库所需的样本量会比较大。
参考文献
【1】Vlachogiannis, G. et al.(2018). Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science, 359(6378), 920-926.
【2】Chen, X. et al.(2021). Phenotype transition of fibroblasts incorporated into patient‐derived oral carcinoma organoids. Oral Diseases.
【3】Ooft, S. N. et al.(2019). Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science translational medicine, 11(513), eaay2574.
【4】Mullins, C. S. et al. (2013). Establishment and characterization of primary glioblastoma cell lines from fresh and frozen material: a detailed comparison. PloS one, 8(8), e71070.
【5】Vogel, T. W. et al.(2005). Proteins and protein pattern differences between glioma cell lines and glioblastoma multiforme. Clinical cancer research, 11(10), 3624-3632.
【6】Wallaschek N. et al. Establishing pure cancer organoid cultures: identification, selection and verification of cancer phenotypes and genotypes[J]. Journal of molecular biology, 2019, 431(15): 2884-2893.
【7】HERPERS, Bram, et al. Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR× LGR5 bispecific antibody with efficacy in epithelial tumors. Nature Cancer, 2022, 1-19.
类器官培养50问-应用篇
Q31: 用于疾病研究的类器官需要最大限度减小差异。但在实际培养过程中,同批次类器官个体之间、以及不同批次类器官样本之间均存在显著差异,这个问题怎样克服呢?
A31: 类器官是由不同类型的细胞组成的结构,并且在体外是自组装的,因此很容易存在同一样本在相同培养条件下的孔间差异。
如果是用于患者个性化医疗的肿瘤类器官,需要更精准地模拟患者体内的特征,这种情况建议采用多个平行来减小差异;
如果是用于机制研究或用作疾病模型的类器官,可以考虑利用“微流控液滴技术”进行工程化培养,相关成果已发表在Cell Reports Medicine【1】。
Q32:目前培养出的类器官可以进行体内移植,用于器官重建吗?
A32:已有动物实验证实过可行性,比如:肠类器官移植小鼠治疗溃疡性结肠炎【2】;胰岛类器官移植小鼠治疗糖尿病【3】。
虽然目前类器官移植尚未进入临床,但在2021年2月,Science【4】首次报道了利用胆道类器官修复离体条件下的人类肝脏,实现了胆道再生,并改善了胆汁性质。
Q33:类器官一般长到什么程度可以用来进行药物测试?
A33:这个问题可以在Nature Protocols【5】找到答案。
对于新鲜培养的类器官:建议对低代次类器官(2-3代)进行药物筛选,以最大限度地减少使用过的培养基或体外突变累积对药物测试的影响。
对于经过冻存的类器官:由于冷冻/解冻可能导致复苏时器官样形态的变化,因此建议类器官至少传代一次再进行药物筛选。如果出现复苏后细胞活力不佳,则需要延长培养时间以恢复细胞状态。
Q34:类器官建立是否成功有怎样的标准吗?
A34:1、判断形态。显微镜下类器官形态可能为空泡状、出芽状、紧密型、松散型等,但整体形态一致。
2、可以鉴定相应的biomarker是否有表达,及分布是否与组织切片相似。
3、是否能够传代3次以上,并可以冻存复苏。
4、如果有条件的话,可以进行测序分析。
Q35:类器官可以进行基因编辑吗?
A35:可以,干细胞来源类器官的基因编辑多用于疾病建模,而肿瘤来源的类器官则多用于寻找疾病相关突变点或治疗靶点,图1列举了类器官基因编辑的部分研究和应用。
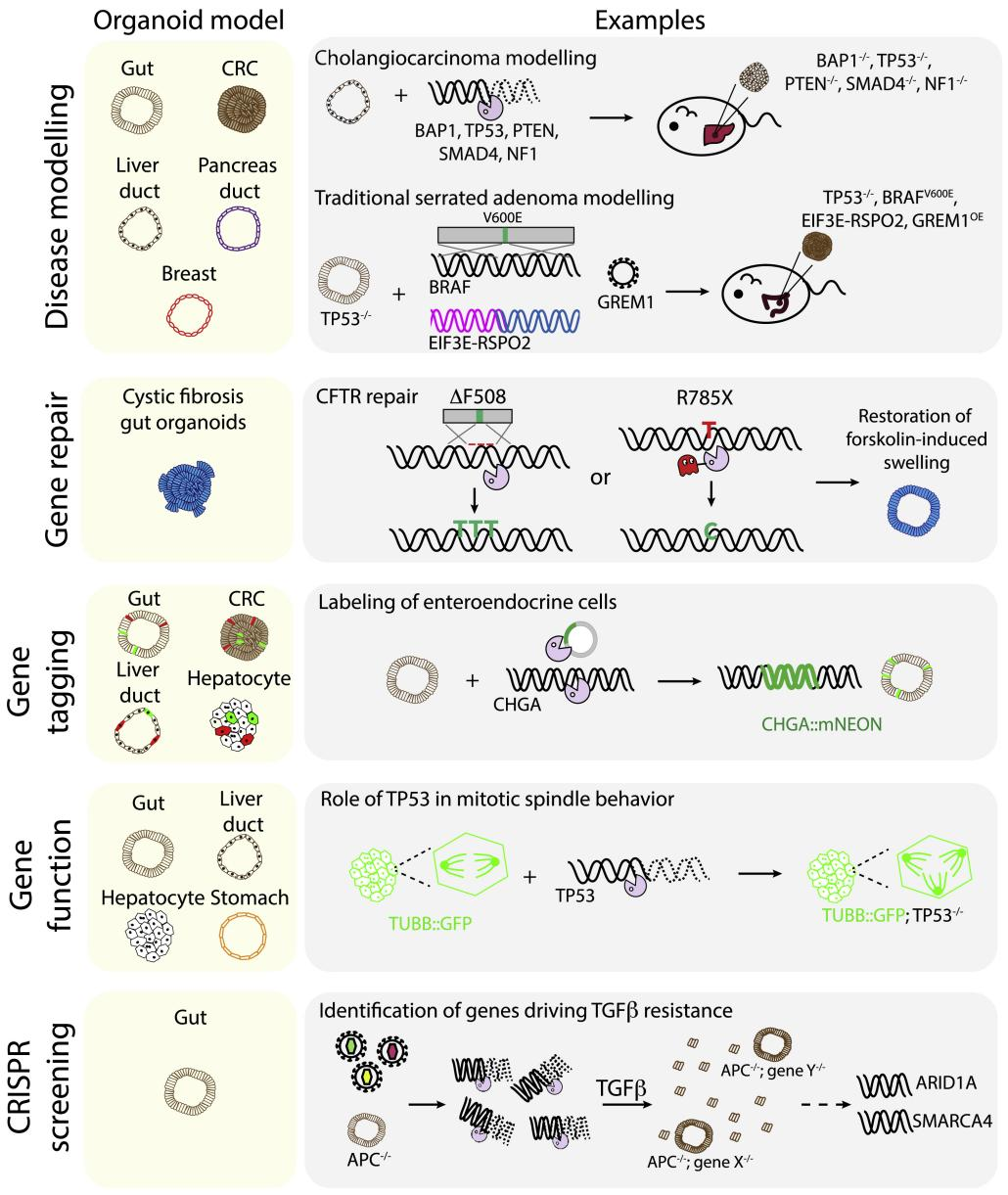
Q36:类器官培养和普通细胞培养有何不同之处?
A36:1、细胞来源有区别:类器官的细胞来源是具有多能性的上皮细胞,而普通细胞培养适用于培养多种类型细胞;
- 细胞培养方式不同:类器官需要基质胶等材料支撑其三维结构,普通细胞培养则不需要;
- 类器官需要实现体外分化和自组装,因此需要多种细胞因子的组合进行诱导,培养基成分复杂。而普通细胞培养通常为单一种类细胞,因此培养基成分较简单;
Q37:用哪种培养基培养来自转移部位肿瘤的类器官,比如原发灶为A类型肿瘤,转移灶为B类型肿瘤?
A37:通常来讲,如果肿瘤发生了转移,我们依然选用相对应的原发灶(A类型)PDO培养基。
Q38: 怎样证明培养出的结构是类器官,而不是简单聚集在一起的细胞团?
A38:类器官的分化方式本质上是在模拟体内的器官发育,因此表达形态及各细胞分布情况与实际器官具有相似性,而细胞团则没有这种规律。我们可以通过免疫荧光的方式检测biomarkers的分布情况来区分。例如下图中的结果表明,肾类器官与肾组织的biomarkers分布高度一致【7】。

Q39:类器官的的来源细胞必须要具有多能性吗?正常组织成熟体细胞可以进行类器官培养吗?
A39:由于类器官涉及到体外分化和自组装,因此来源细胞必须具有多能性。正常组织的成熟体细胞中往往会有一部分成体干细胞(标志物为Lgr5,CD133等),这部分细胞也可以进行类器官培养。
Q40:可以通过构建条件性培养基代替商品化的细胞因子吗?
A40:依据Hans Clevers实验室早期发表的文章,可以采用条件性培养基代替纯化的细胞因子进行类器官培养,但同时也需要考虑条件性培养基的不足之处。小编总结了条件性培养基和近岸细胞因子的参数差异。
| 条件性培养基 | 近岸蛋白细胞因子 | |
| 细胞因子含量和活性检测 | 含有多种蛋白质,不易检测,且每批次都要重新进行检测 | 单一蛋白质组分,能够提供准确的细胞因子含量和活性数据 |
| 纯度 | 含有大量细胞代谢产物,纯度较低 | 纯度可达到95%以上 |
| 储存 | 由于条件性培养基是液体,因此不论是短期冷藏保存,还是长期冻存,都会降低细胞因子活性 | 通常为冻干粉,可以长期保存而不影响活性 |
| 内毒素 | 通常没有去除内毒素的步骤 | 内毒素低于10EU/mg |
| 批间一致性 | 不能完全控制培养条件,批间一致性较差 | 重组技术表达,生产环节精准可控,批间差异小 |
总的来说,条件性培养基对于部分预实验或少量类器官培养是可行的,但鉴于质粒构建和验证消耗的时间,以及检测过程涉及的抗体、qPCR等成本也是需要考虑在内的。同时,细胞代谢产物、内毒素和宿主残留物等也有可能影响实验结果。因此,选用高品质的商品化细胞因子能够帮您节约时间和金钱成本,快速推动类器官培养进程。
参考文献
【1】Jiang, Shengwei, et al.. (2020). An automated organoid platform with inter-organoid homogeneity and inter-patient heterogeneity. Cell Reports Medicine, 1(9), 100161.
【2】WATANABE, Satoshi, et al. Transplantation of intestinal organoids into a mouse model of colitis. Nature Protocols, 2022, 1-25.
【3】Wang, D. et al. (2020). Long-term expansion of pancreatic islet organoids from resident Procr+ progenitors. Cell, 180(6), 1198-1211.
【4】Sampaziotis, F. et al. (2021). Cholangiocyte organoids can repair bile ducts after transplantation in the human liver. Science, 371(6531), 839-846.
【5】Driehuis, E., Kretzschmar, K., & Clevers, H. (2020). Establishment of patient-derived cancer organoids for drug-screening applications. Nature protocols, 15(10), 3380-3409.
【6】Hendriks, D., Clevers, H., & Artegiani, B. (2020). CRISPR-Cas tools and their application in genetic engineering of human stem cells and organoids. Cell Stem Cell, 27(5), 705-731.
【7】Czerniecki, S. M. et al. (2018). High-throughput screening enhances kidney organoid differentiation from human pluripotent stem cells and enables automated multidimensional phenotyping. Cell stem cell, 22(6), 929-940.
类器官培养50问-实际操作篇
Q41: 按照文献方法进行类器官培养,为什么观察到的形态却和文献不一致?
A41: 决定类器官形态的因素有很多,样本来源是否相同、选用的细胞因子品质是否有差异都有可能改变最终的类器官形态。这里举一个文献中的例子,分别取四个高级别浆液性(HGS)卵巢癌患者的肿瘤组织,用同样的条件进行类器官培养,H&E染色结果显示它们的形态千差万别【1】。因此对于类器官的鉴定,我们不能局限于形态观察,需要使用多种方法相结合。

Q42:类器官的药敏实验中需要使用DMSO作为药物的溶剂,需要控制DMSO的用量吗?
A42:考虑到DMSO这类有机物的细胞毒性,建议终浓度不超过0.1%(v/v)。
Q43:培养过程中发现类器官培养物中有黑色小颗粒,这个是杂质吗?应该怎样去除?
A43:黑色小颗粒大概率是杂质或细胞碎片,去除它们有以下两种方式可以参考:
1、将类器官消化下来,用培养基进行反复清洗,达到稀释杂质的作用;
2、用无菌手术刀将类器官切成两半,取1ml注射器吸满培养基并轻轻推出,冲洗类器官中的杂质【2】。
Q44:对于肿瘤患者的个性化医疗测试,PDO、PDX、PDXO的模型可以相互结合使用吗?
A44:PDO、PDX、PDXO模型有各自的优势,通常有以下两种结合方式:PDO-PDX和PDX-PDXO。
1、PDO-PDX是性价比更高的方式,即:先利用PDO进行高通量的药物筛选,筛选出有效的药物再进行PDX测试。
2、PDX-PDXO是更精准的药物测试方式,即:先利用PDX产生大量的体内肿瘤,然后将这些肿瘤分离进行PDXO培养,此时可以通过PDX模型,将PDXO的药敏实验结果与体内用药结果一一对应,进而预测人体用药的结果,实现对患者更精准的用药指导;并且可以用PDX模型将转移后的肿瘤分离,同样进行PDXO培养和用药,能够更精确地对转移灶进行药物筛选。
Q45:类器官怎么从基质胶中回收?
A45:1、将类器官放置在冰上,待基质胶融化后离心进行回收,这种方式适用于不需要将类器官结构完全打散的情况;
2、市售的细胞回收液,可以温和有效地获得细胞悬液,不会损伤细胞或细胞表面蛋白。
Q46:为什么用基质胶来培养类器官?可以用其它类型的凝胶替代吗?
A46:基质胶能够为类器官提供支撑作用,目前类器官培养用的基质胶来源于小鼠肉瘤的基底膜基质,其中含有约60%层粘连蛋白、30% IV 胶原和8%的巢蛋白,还含有基底膜聚糖、TGF-ß、表皮生长因子、类胰岛素生长因子、组织纤溶酶原等1800多种独特的蛋白质。由于基质胶中各因子的不确定性,并且存在批次间差异,因此目前也有一些聚焦于基质胶替代方案的研究,如图2【3】。
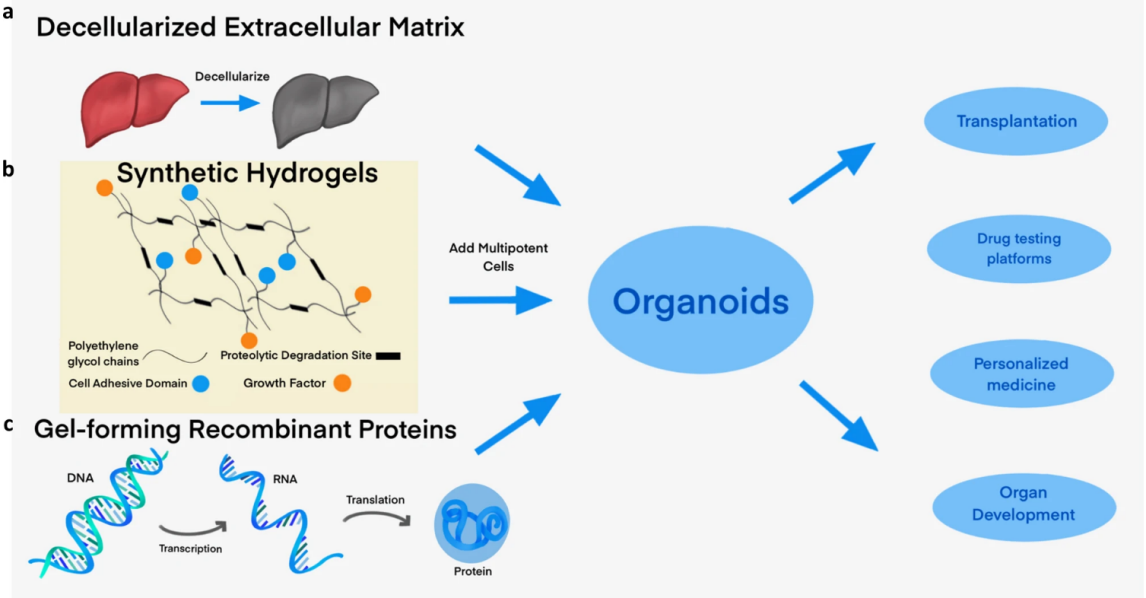
Q47:怎样确定某一种类器官的培养方式更适用于基质胶包埋法还是气-液交互法呢?
A47:1、根据所模拟的器官自身生长情况选择,例如:皮肤的正常生长是有一面需要接触空气,那么对于皮肤类器官的培养倾向于利用气-液交互法来培养【4】;
2、考虑所培养的类器官模型的应用方向,例如:气-液交互法培养易于进行病毒感染实验,因此用于病毒感染实验的气道类器官会优先选择气-液交互法培养【5】。
Q48:在进行药敏实验前,类器官的接种方式是怎样的呢?
A48:药物筛选前,通常将类器官吹散后,用含2%-5%基质胶的培养基悬浮,并最终铺在基质胶包被的孔板中【6-7】。
Q49:在离心回收时,会有很多类器官粘附在离心管壁,有没有更好的办法提高回收率?
A49:建议采用水平转子代替角转子,可以有效减少类器官挂在离心管壁的情况。
Q50:利用肿瘤类器官模型进行筛选的药物有什么局限性吗?
A50:1、抗体药物因为需要免疫细胞的参与,因此肿瘤类器官不能筛选抗体类药物,此类药物筛选需要构建肿瘤类器官-肿瘤微环境的模型来实现;
由于肿瘤类器官中没有对血管进行培养,因此抗血管类的药物也同样不能进行筛选。
参考文献
【1】Kopper, O. et al. (2019). An organoid platform for ovarian cancer captures intra-and interpatient heterogeneity. Nature medicine, 25(5), 838-849.
【2】MILLER, Alyssa J., et al. Generation of lung organoids from human pluripotent stem cells in vitro. Nature protocols, 2019, 14.2: 518-540.
【3】Kozlowski, M. T. et al. (2021). Towards organoid culture without Matrigel. Communications biology, 4(1), 1-15.
【4】Gangatirkar, P. et al. (2007). Establishment of 3D organotypic cultures using human neonatal epidermal cells. Nature protocols, 2(1), 178-186.
【5】Mulay, A. et al. (2021). SARS-CoV-2 infection of primary human lung epithelium for COVID-19 modeling and drug discovery. Cell reports, 35(5), 109055.
【6】Van de Wetering, M. et al. (2015). Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell, 161(4), 933-945.
【7】Hirt, C. K. et al. (2022). Drug screening and genome editing in human pancreatic cancer organoids identifies drug-gene interactions and candidates for off-label therapy. Cell genomics, 2(2), 100095.
近岸蛋白自主研发生产的低内毒素Activin A、FGF系列、HGF、R-Spondin 1、Noggin和Wnt3a等细胞因子,内毒素低至<10EU/mg,具有高活性、高纯度、高批间一致性,为类器官培养设计,已获得市场认可,让您研究放心!
